��Ŀ����
14����֪��CH3COOH?CH3COO-+H+�ﵽ����ƽ��ʱ������ƽ�ⳣ�����Ա�ʾΪKa=$\frac{c��C{H}_{3}CO{O}^{-}��•c��{H}^{+}��}{c��C{H}_{3}COOH��}$��CH3COO-+H2O?CH3COOH+OH-�ﵽˮ��ƽ��ʱ��ˮ��ƽ�ⳣ�����Ա�ʾΪKb=$\frac{c��C{H}_{3}COOH��•c��O{H}^{-}��}{c��C{H}_{3}CO{O}^{-}��}$��ʽ�и���Ũ�Ⱦ�Ϊƽ��ʱŨ�ȣ�����1����������������������������ƽ�ⳣ��Ka����Ӧ���ӵ�ˮ�ⳣ��Kb�Լ�ˮ�����ӻ�����KW�Ĺ�ϵ��c��H+����c��OH-��=Kw���ɴ˿����ƶϣ�������ʵĵ���̶�ԽС�����Ӧ���ӵ�ˮ��̶�Խ��
��2�������25��ʱCH3COOH�ĵ���ƽ�ⳣ��Ka=1.8��10-5������¶���0.18 mol•L-1��CH3COONa��Һ��pH=9��
���� ��1���Դ���Ϊ����Ka=$\frac{c��C{H}_{3}CO{O}^{-}��•c��{H}^{+}��}{c��C{H}_{3}COOH��}$��Kb=$\frac{c��C{H}_{3}COOH��•c��O{H}^{-}��}{c��C{H}_{3}CO{O}^{-}��}$��Ka��Kb=$\frac{c��C{H}_{3}CO{O}^{-}��•c��{H}^{+}��}{c��C{H}_{3}COOH��}$.$\frac{c��C{H}_{3}COOH��•c��O{H}^{-}��}{c��C{H}_{3}CO{O}^{-}��}$=c��H+����c��OH-��=Kw�����ݹ�ʽ֪��������ʵĵ���ƽ�ⳣ������ˮ��ƽ�ⳣ���ɷ��ȣ�
��2�������25��ʱCH3COOH�ĵ���ƽ�ⳣ��Ka=1.8��10-5������ˮ��ƽ�ⳣ��Kb=$\frac{1{0}^{-14}}{1.8��1{0}^{-5}}$=$\frac{5}{9}$��10-9��
ˮ����������ɵ�c��OH-��=c��CH3COOH��=$\sqrt{{K}_{b}��c��C{H}_{3}CO{O}^{-}��}$=$\sqrt{\frac{5}{9}��1{0}^{-9}��0.18}$mol/L=10-5 mol/L������Һ��c��H+��=$\frac{1{0}^{-14}}{1{0}^{-5}}$mol/L=10-9mol/L���ݴ˼�����ҺpH��
��� �⣺��1���Դ���Ϊ����Ka=$\frac{c��C{H}_{3}CO{O}^{-}��•c��{H}^{+}��}{c��C{H}_{3}COOH��}$��Kb=$\frac{c��C{H}_{3}COOH��•c��O{H}^{-}��}{c��C{H}_{3}CO{O}^{-}��}$��Ka��Kb=$\frac{c��C{H}_{3}CO{O}^{-}��•c��{H}^{+}��}{c��C{H}_{3}COOH��}$.$\frac{c��C{H}_{3}COOH��•c��O{H}^{-}��}{c��C{H}_{3}CO{O}^{-}��}$=c��H+����c��OH-��=Kw�����ݹ�ʽ֪��������ʵĵ���ƽ�ⳣ������ˮ��ƽ�ⳣ���ɷ��ȣ�����������ʵĵ���̶�ԽС�����Ӧ�����ӵ�ˮ��̶�Խ��
�ʴ�Ϊ��c��H+����c��OH-��=Kw��Խ��
��2�������25��ʱCH3COOH�ĵ���ƽ�ⳣ��Ka=1.8��10-5������ˮ��ƽ�ⳣ��Kb=$\frac{1{0}^{-14}}{1.8��1{0}^{-5}}$=$\frac{5}{9}$��10-9��
ˮ����������ɵ�c��OH-��=c��CH3COOH��=$\sqrt{{K}_{b}��c��C{H}_{3}CO{O}^{-}��}$=$\sqrt{\frac{5}{9}��1{0}^{-9}��0.18}$mol/L=10-5 mol/L������Һ��c��H+��=$\frac{1{0}^{-14}}{1{0}^{-5}}$mol/L=10-9mol/L�������ҺpH=9��
�ʴ�Ϊ��9��
���� ���⿼��������ʵĵ��롢����ˮ�������ӻ�������ϵ��Ϊ��Ƶ���㣬���ؿ���ѧ�����������������ѵ��ǣ�2������㣬ע�⣺�������д��������ˮ��̶Ⱥ�С��������Һ�д��������Ũ��Լ���ڴ�����Ũ�ȣ�Ϊ�״��㣮

 ijʵ��С����������װ�úϳɻ���ԭ������ȩ�������ķ�Ӧ���£�
ijʵ��С����������װ�úϳɻ���ԭ������ȩ�������ķ�Ӧ���£�CH3CH2CH2CH2OH$��_{H_{2}SO_{4}����}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO��Ӧ��Ͳ������������б����£�
| �е�/�� | �ܶ�/��g•cm-3�� | ˮ���ܽ��� | |
| ������ | 117.2 | 0.810 9 | �� |
| ����ȩ | 75.7 | 0.801 7 | �� |
��6.0g Na2Cr2O7����100mL�ձ��У���30mLˮ�ܽ⣬�ٻ�������5mLŨ���ᣬ��������ҺС��ת����B�У���A�м���4.0g�������ͼ�����ʯ�����ȣ�������������ʱ����ʼ�μ�B����Һ���μӹ����б��ַ�Ӧ�¶�Ϊ90��95�棬��C���ռ�90�����µ���֣�������ﵹ���Һ©���У���ȥˮ�㣬�ٽ��л���������������ȩ2.0g���ش��������⣺
��1��ʵ���в��ܽ�Na2Cr2O7��Һ�ӵ�Ũ�����е�������Ũ��������ˮ��ų������ȣ����������ˣ�
��2�������ʯ�������Ƿ�ֹ���У�
��3����Һ©��ʹ��ǰ������еIJ����Ǽ���Ƿ�©ˮ��
��4����Ӧ�¶�Ӧ������90��95�棬��ԭ���DZ�֤����ȩ��ʱ�������ֿɾ��������䱻��һ��������
��5����ʵ���У�����ȩ�IJ���Ϊ51.4%��
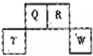 ������Ԫ��Q��R��T��W��Ԫ�����ڱ��е�λ����ͼ��ʾ������T��������������������������ȣ�����˵����ȷ���ǣ�������
������Ԫ��Q��R��T��W��Ԫ�����ڱ��е�λ����ͼ��ʾ������T��������������������������ȣ�����˵����ȷ���ǣ�������| A�� | W�����ڱ��е�λ���ǵ������ڣ���A�� | |
| B�� | ԭ�Ӱ뾶Q��R��T | |
| C�� | Wԭ�ӵõ�������ǿ��Qԭ�ӣ��ҿ��γɹ��ۻ�����QW2 | |
| D�� | ԭ��������R��1��Ԫ��ֻ��һ���⻯�� |
| A�� | ��ˮ���ȵ�100��ʱ��ˮ��pH=6 | B�� | ��ˮ�еμ�����ϡH2SO4 | ||
| C�� | ��ˮ�м�������NaHCO3 | D�� | ��ˮ�м��������������� |
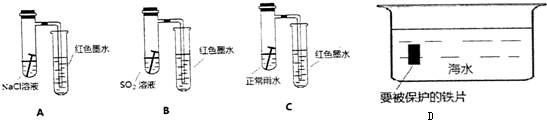
| A�� | ʵ����������������ͨ��������ú���� | |
| B�� | ����ͨ��ʱ������ɲ��������ЧӦ | |
| C�� | ������Һ���ǵ��ʣ���ˮ���Ȼ��⡢�����ǻ���� | |
| D�� | ��ֻҪ���������ĥ���롱ֻ�漰�����仯 |
 ��
��
 ��E���Խ�����Ȫʵ�����Ҫԭ���ǣ���ΪNH3��������ˮ��
��E���Խ�����Ȫʵ�����Ҫԭ���ǣ���ΪNH3��������ˮ�� NH3��H2O+H+
NH3��H2O+H+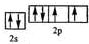 ����Ԫ�ص�����������
����Ԫ�ص�����������