题目内容
10.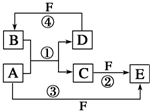 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).(1)若A为短周期金属单质,D为短周期非金属固体单质,且所含元素的原子序数A是D的2倍,元素的原子最外层电子数D是A的2倍,F的浓溶液与A、D反应都有红棕色气体生成,则A的离子结构示意图为
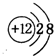 ,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.(2)若A是常见的变价金属的单质,D、F是气态单质,且反应①在水溶液中进行.反应②也在水溶液中进行,其离子方程式是2Fe2++Cl2═2Fe3++2Cl-,用电子式表示化合物B的形成过程:
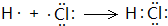 .
.(3)若A、D、F都是短周期非金属元素单质,D的M层电子是L层电子的一半,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
分析 (1)A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,则A为Mg,D为C,反应①为Mg与CO2的反应生成C与MgO,则A为Mg,B为CO2,C为MgO,F的浓溶液与A、D反应都有红棕色气体生成,F为浓HNO3;
(2)A是常见的变价金属的单质,D、F是气态单质,反应①在水溶液中进行,应是金属与酸的反应,由反应②③可知F具有强氧化性,则A为Fe,D为H2,F为Cl2,B为HCl,C为FeCl2,E为FeCl3;
(3)若A、D、F都是短周期非金属元素单质,D的M层电子是L层电子的一半,则其M层电子数为4,故D为Si,A、D同主族,则A为碳元素,A、F所含元素同周期,A+B=C+D是非金属单质的置换反应,可知B为SiO2,F为O2.
解答 解:(1)A为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数A是D的2倍,则A为Mg,D为C,反应①为Mg与CO2的反应生成C与MgO,则A为Mg,B为CO2,C为MgO,F的浓溶液与A、D反应都有红棕色气体生成,F为浓HNO3,则:
Mg2+离子结构示意图为 ,反应④是碳和浓硝酸加热反应生成二氧化氮、二氧化碳气体及水,反应化学方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
,反应④是碳和浓硝酸加热反应生成二氧化氮、二氧化碳气体及水,反应化学方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
故答案为: ;C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
;C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
(2)A是常见的变价金属的单质,D、F是气态单质,反应①在水溶液中进行,应是金属与酸的反应,由反应②③可知F具有强氧化性,则A为Fe,D为H2,F为Cl2,B为HCl,C为FeCl2,E为FeCl3,反应②在水溶液中进行反应,其离子方程式是:2Fe2++Cl2═2Fe3++2Cl-,用电子式表示化合物HCl的形成过程: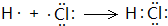
故答案为:2Fe2++Cl2═2Fe3++2Cl-;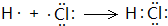 ;
;
(3)若A、D、F都是短周期非金属元素单质,D的M层电子是L层电子的一半,则其M层电子数为4,故D为Si,A、D同主族,则A为碳元素,A、F所含元素同周期,A+B=C+D是非金属单质的置换反应,可知B为SiO2,F为O2,反应①是碳置换硅的反应,化学方程式为为:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,
故答案为:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
点评 本题考查无机物推断,需要学生掌握元素化合物性质,注意掌握中学常见的置换反应、连续反应,难度中等.

| A. | ①③②④ | B. | ③④②① | C. | ①③④② | D. | ③①②④ |
| A. | 相对分子质量相同的几种化合物,互称为同分异构体 | |
| B. | 某有机物燃烧只生成CO2和H2O,且二者物质的量相同,则此有机物的组成为CnH2n | |
| C. | 满足同一通式的有机物,彼此一定是同系物 | |
| D. | 组成元素的质量分数相同,且相对分子质量也相同的不同化合物,一定互为同分异构体 |
| A. | 金刚石比石墨稳定 | |
| B. | 石墨比金刚石稳定 | |
| C. | 1mol石墨比1mol金刚石的总能量高 | |
| D. | 1mol金刚石生成1mol石墨要吸收热量 |
 把1体积CH4和4体积Cl2组成的混合气体冲入大试管中,将此试管倒立在盛有Na2SiO3溶液的水槽里,放在光亮处.
把1体积CH4和4体积Cl2组成的混合气体冲入大试管中,将此试管倒立在盛有Na2SiO3溶液的水槽里,放在光亮处.
 .a曲线表示的离子方程式为AlO2-+H++H2O==Al(OH)3↓
.a曲线表示的离子方程式为AlO2-+H++H2O==Al(OH)3↓