题目内容
8.4gD2和20g18O2化合时最多能生成22g D218O,1mol D218O中含10mol质子,含12mol中子.分析 根据方程式结合反应物的物质的量计算.
解答 解:4g D2的物质的量为$\frac{4g}{4g/mol}$=1mol,20g 18O2的物质的量为n(18O2)=$\frac{20g}{36g/mol}$=$\frac{5}{9}$mol;2D2+18O2=2D218O,则 18O2过量按照D2计算,所以生成的D218O为1mol,
则D218O的质量为22g;1个D218O中含有1×2+8=10个质子,含有1×2+10=12个中子,所以1molD218O中含有10mol质子,12mol中子,
故答案为:22;10;12.
点评 本题考查了根据方程式的计算,微粒数目的求算,题目难度较小,注意D中质子数和中子数都是1.

练习册系列答案
相关题目
18.氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种价态,该族元素的化合物在研究和生产中有许多重要用途.下列有关说法正确的( )
| A. | H2O2、H2S、H2Se分子中均只含极性键 | |
| B. | 沸点:H2O<H2S<H2Se | |
| C. | 稳定性:H2O<H2S<H2Se | |
| D. | 上述元素的最高价氧化物对应的水化物中酸性最强的是H2SO4 |
3.运用元素周期律分析下面的推断,其中不正确的是( )
| A. | 硫酸锶(SrSO4)是难溶于水的白色固体 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| D. | 硒化氢(H2Se)是有色、有毒的气体,比H2S稳定 |
17.化学实验中常将溶液或试剂进行酸化,下列酸化处理的措施正确的是( )
| A. | 检验溶液中是否含有SO32-时,用硝酸酸化后再加BaCl2溶液 | |
| B. | 为增强高锰酸钾的氧化能力,向高锰酸钾溶液中加入稀硝酸酸化 | |
| C. | 检验溶液中是否含有Fe2+时,用硝酸酸化后,加KSCN溶液 | |
| D. | 检验溶液中是否含有SO42-时,用盐酸酸化后,加BaCl2溶液 |
 .
.
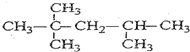 .
.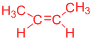 、
、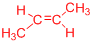 .
.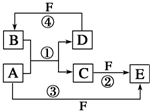 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出). ,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.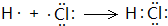 .
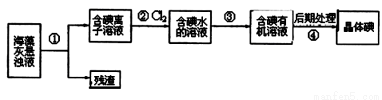
. 碘的流程的一部分
碘的流程的一部分