题目内容
19. 把1体积CH4和4体积Cl2组成的混合气体冲入大试管中,将此试管倒立在盛有Na2SiO3溶液的水槽里,放在光亮处.
把1体积CH4和4体积Cl2组成的混合气体冲入大试管中,将此试管倒立在盛有Na2SiO3溶液的水槽里,放在光亮处.(1)试管中观察到的现象:①试管中气体颜色会变浅
②水位在试管内上升
③试管壁上有油状液滴
(2)水槽中观察到的现象生成沉淀
(3)写出有关反应的化学方程式:
①CH4与Cl2反应(第一步)CH4+Cl2 $\stackrel{光照}{→}$CH3Cl+HCl
②Na2SiO3溶液中发生的反应2HCl+Na2SiO3=2NaCl+H2SiO3↓,
(4)待反应完成后,测得4种取代物物质的量相等,则反应中消耗Cl2为2.5体积.
分析 (1)氯气在光照条件下发生了取代反应,生成的物质有:CH3Cl(气体)、CH2Cl2、CHCl3、CCl4、HCl;
①生成的产物均无色;
②反应生成了氯化氢,氯化氢易溶于水;
③生成的CH2Cl2、CHCl3、CCl4常温下均为无色液体油状液滴;
(2)氯化氢是强酸,溶于水后与溶液中硅酸钠反应置换出硅酸,硅酸不溶于水;
(3)依据负原理书写化学反应方程式即可;
(4)根据甲烷的物质的量计算出四种取代产物的物质的量,再根据甲烷与氯气的取代反应特点计算出消耗氯气的物质的量.
解答 解:(1)CH4和Cl2光照发生反应:CH4+Cl2 $\stackrel{光照}{→}$CH3Cl+HCl,CH3Cl+Cl2 $\stackrel{光照}{→}$CH2Cl2+HCl,CH2Cl2+Cl2 $\stackrel{光照}{→}$CHCl3+HCl,CHCl3+Cl2 $\stackrel{光照}{→}$CCl4+HCl,生成CH3Cl(气体)、CH2Cl2、CHCl3、CCl4、HCl,
①生成的产物均无色,所以试管中气体颜色会变浅,故答案为:试管中气体颜色会变浅;
②因生成的HCl易溶于水,反应后,试管内气体压强减小,水位在试管内上升,故答案为:水位在试管内上升;
③因生成的HCl易溶于水,反应后,试管内上方有酸雾,由于生成的CH2Cl2、CHCl3、CCl4常温下均为无色液体,使试管壁上有油状液滴,故答案为:试管壁上有油状液滴;
(2)氯化氢是强酸,溶于水后与溶液中硅酸钠反应置换出硅酸,硅酸不溶于水,即有沉淀生成,故答案为:生成沉淀;
(3)①CH4与Cl2反应方程式为:CH4+Cl2 $\stackrel{光照}{→}$CH3Cl+HCl,故答案为:CH4+Cl2 $\stackrel{光照}{→}$CH3Cl+HCl;
②HCl与Na2SiO3溶液反应生成硅酸和氯化钠,反应方程式为:2HCl+Na2SiO3=2NaCl+H2SiO3↓,故答案为:2HCl+Na2SiO3=2NaCl+H2SiO3↓;
(4)1mol甲烷与氯气完全反应生成四种有机产物的物质的量相同,即分别生成了0.25molCH3Cl(气体)、CH2Cl2、CHCl3、CCl4,根据取代反应特点,每取代1molH原子,需要消耗1mol氯气,则总共消耗氯气的物质的量为:0.25mol+0.25mol×2+0.25mol×3+0.25mol×4=2.5mol,即1体积甲烷消耗2.5体积氯气,故答案为:2.5.
点评 本题考查了甲烷的取代反应原理,题目难度不大,注意掌握甲烷的化学性质,明确取代反应原理,(2)为易错点,注意反应产物与有机产物的不同及甲烷与氯气的取代反应特点.

 名校课堂系列答案
名校课堂系列答案| A. | 液态水气化 | B. | 氢气燃烧 | ||
| C. | 浓硫酸的稀释 | D. | Ba(OH)2•8H2O和NH4Cl(s)混合 |
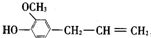 ,按官能团分类,它不属于( )
,按官能团分类,它不属于( )| A. | 烯类 | B. | 酚类 | C. | 醚类 | D. | 醇类 |
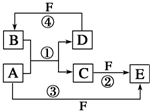 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出). ,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.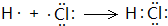 .
.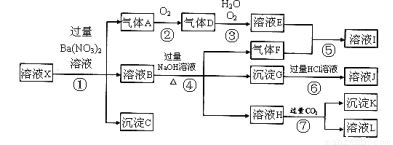
 液X中一定不存在的离子有:
液X中一定不存在的离子有: 为
为 ;
;