题目内容
15.将SO2通入下列溶液中,溶液褪色或颜色变浅,说明SO2具有还原性的是( )①KMnO4(H+,aq)
②红色酚酞溶液
③碘水 ④品红
⑤Fe3+(aq)
| A. | ①②③ | B. | ①③⑤ | C. | 全部 | D. | 都不是 |
分析 SO2具有酸性氧化物的通性、还原性、漂白性等性质,可与溴水、高锰酸钾等氧化剂发生氧化还原反应,以此解答该题.
解答 解:①SO2具有还原性,KMnO4酸性溶液具有氧化性,二者发生氧化还原反应而使紫红色KMnO4酸性溶液褪色,故正确;
②SO2具有酸性氧化物的通性,与碱发生反应生成盐和水而导致溶液PH减小,溶液 褪色或颜色变浅,故错误;
③SO2具有还原性,碘水具有氧化性,二者发生SO2+I2+2H2O═H2SO4+2HI,使碘水褪色,是由于SO2具有还原性,故正确;
④SO2具有漂白性,可使品红褪色,故错误;
⑤SO2具有还原性,Fe3+(aq)具有氧化性,二者发生氧化还原反应而使Fe3+(aq)褪色,故正确.
故选B.
点评 本题考查二氧化硫的性质,综合考查元素化合物知识,为高频考点,把握二氧化硫的漂白性、还原性为解答的关键,侧重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
8.现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
(1)B基态原子中能量最高的电子所处的能级为2p其电子云在空间有3个方向,原子轨道呈纺锤形;
(2)某同学根据上述信息,推断C基态原子的核外电子排布为,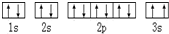 ,该同学所画的电子排布图违背了泡利不相容原理
,该同学所画的电子排布图违背了泡利不相容原理
(3)G位于ⅦB族d区,价电子排布式为3d54s2
(4)DE3中心原子的杂化方式为sp3,用价层电子对互斥理论推测其空间构型为三角锥形
(5)1mol(SCN)2分子中含有σ键的数目为5NA;类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因是异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键.
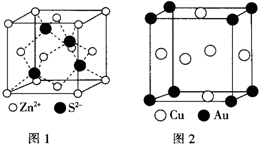
(6)ZnS的晶胞结构如图1所示,在ZnS晶胞中,S2-的配位数为4.
(7)铜与金形成的金属互化物结构如图2,其晶胞边长为a nm,该金属互化物的密度为$\frac{389}{{N}_{A}×{a}^{3}×1{0}^{-21}}$(用含“a、NA 的代数式表示)g•cm-3.

| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 G在周期表的第七列 |
(2)某同学根据上述信息,推断C基态原子的核外电子排布为,
 ,该同学所画的电子排布图违背了泡利不相容原理
,该同学所画的电子排布图违背了泡利不相容原理(3)G位于ⅦB族d区,价电子排布式为3d54s2
(4)DE3中心原子的杂化方式为sp3,用价层电子对互斥理论推测其空间构型为三角锥形
(5)1mol(SCN)2分子中含有σ键的数目为5NA;类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H-S-C≡N)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因是异硫氰酸分子间可形成氢键,而硫氰酸分子间不能形成氢键.
(6)ZnS的晶胞结构如图1所示,在ZnS晶胞中,S2-的配位数为4.
(7)铜与金形成的金属互化物结构如图2,其晶胞边长为a nm,该金属互化物的密度为$\frac{389}{{N}_{A}×{a}^{3}×1{0}^{-21}}$(用含“a、NA 的代数式表示)g•cm-3.
9.为提纯下列物质(括号内的物质是杂质),所选用的除杂实际和分离方法都正确的是( )
| 被提纯的物质 | 除杂试剂 | 分离方法 | |
| A | SO2(乙炔) | 溴水 | 洗气 |
| B | 苯(溴) | KI溶液 | 分液 |
| C | 乙醇(乙酸) | 饱和Na2CO3溶液 | 蒸馏 |
| D | 乙烷(乙烯) | KMnO4溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
6.a、b、c、d、e 是同周期的五种主族元素,a和b的最高价氧化物的水化物显碱性,且碱性 b>a,c 和 d 的气态氢化物的稳定性 d>c,e 为金属元素.五种元素的原子得失电子后所形成的简单离子中,e 的离子半径最小,则它们的原子序数由小到大的顺序是( )
| A. | baecd | B. | edabc | C. | abdce | D. | ebadc |
7.有机物丁香油酚的结构式为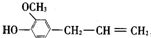 ,按官能团分类,它不属于( )
,按官能团分类,它不属于( )
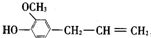 ,按官能团分类,它不属于( )
,按官能团分类,它不属于( )| A. | 烯类 | B. | 酚类 | C. | 醚类 | D. | 醇类 |
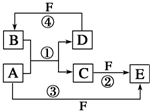 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出). ,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.
,反应④的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O.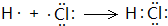 .
. 体中的氢原子数一定大于2NA
体中的氢原子数一定大于2NA