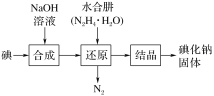
题目内容
【题目】下列与化工生产相关描述不合理的是
A.在合成氨工业中,低温、高压有利于提高合成氨平衡产率
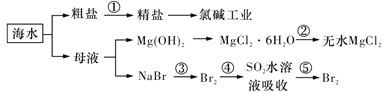
B.在上图海水的综合利用中![]() 均为氧化还原反应
均为氧化还原反应
C.硫酸工业的基本流程:FeS2![]() SO2
SO2![]() SO3
SO3![]() H2SO4
H2SO4
D.可以采用如下方法制备硅:二氧化硅和适量的炭粉混合,高温反应得到粗硅,利用粗硅和氯气反应,其产物在高温下被氢气还原,从而得到较纯的硅
【答案】C
【解析】
A. 合成氨反应为N2+3H2![]() 2NH3 H<0,低温、高压都有利于平衡正向移动,从而提高合成氨平衡产率,A正确;
2NH3 H<0,低温、高压都有利于平衡正向移动,从而提高合成氨平衡产率,A正确;
B. 在上图海水的综合利用中,③为2NaBr+Cl2=2NaCl+Br2、④为Br2+SO2+2H2O
=2HBr+H2SO4、⑤为2NaBr+Cl2=2NaCl+Br2,均为氧化还原反应,B正确;
C. 硫酸工业中,SO3转化为H2SO4不需要O2参与,C错误;
D.工业制硅经过:SiO2+2C![]() Si+2CO↑、Si+2Cl2
Si+2CO↑、Si+2Cl2![]() SiCl4、SiCl4+2H2
SiCl4、SiCl4+2H2![]() Si+4HCl
Si+4HCl
三步,从而获得高纯硅,D正确。
故选C。

【题目】根据下列实验操作和现象所得到的结论正确的是![]()
![]()
选项 | 实验操作 | 实验现象 | 结论 |
A | 向足量含KSCN的 | 溶液变黄 | 还原性:Fe2+>Br- |
B | 向2mL浓度为 | 开始出现白色沉淀,后出现黄色沉淀 |
|
C | 取等质量的Al和Fe,分别与足量的稀硫酸反应 | Al产生的氢气多 | 金属性: |
D | 向苯酚浊液中滴加饱和 | 浊液变澄清 | 酸性:苯酚 |
A.AB.B/span>C.CD.D
【题目】我国高铁、航空航天、手机制造等都已经跻身世界一流水平,根据下列材料的应用回答问题。
应用 | “复兴号”高铁车轮 | “鲲龙”水陆两栖飞机零部件 | 华为折叠手机屏幕 |
用到的材料 | 高速钢 | 钛合金、铝合金 | 聚酰亚胺塑料 |
(1)上述材料中属于有机合成材料的是______,属于金属材料的是______(写一种即可)。
(2)飞机外壳用钛合金、铝合金的优点是______。
(3)在对高铁钢轨中的缝隙进行焊接时,常用铝和氧化铁在高温条件下反应生成熔融状态下的铁和另一种氧化物。写出该反应的化学方程式为______,反应基本类型是______。
【题目】水浴加热滴加酚酞的NaHCO3溶液,颜色及pH随温度变化如下(忽略水的挥发):
时间 | ① | ② | ③ | ④ | ⑤ |
温度/℃ | 20 | 30 | 40 | 从40℃冷却到20℃ | 沸水浴后冷却到20℃ |
颜色变化 | 红色略加深 | 红色接近① | 红色比③加深较多 | ||
pH | 8.31 | 8.29 | 8.26 | 8.31 | 9.20 |
下列说法不正确的是( )
A.NaHCO3溶液显碱性的原因:HCO3-+H2O![]() H2CO3+OH-
H2CO3+OH-
B.①→③的过程中,颜色加深的原因可能是HCO3-水解程度增大
C.①→③的过程中,pH略微下降说明升温过程中c(OH-)减小
D.⑤比①pH增大,推测是由于NaHCO3分解生成的Na2CO3的缘故