题目内容
已知短周期元素的离子aW3+、bX+、cY2-、dZ-具有相同的电子层结构,下列关系正确的是( )。
| A.质子数c>b |
| B.原子半径X<W |
| C.氢化物的稳定性H2Y>HZ |
| D.离子的还原性Y2->Z- |
D
试题分析:aW3+、bX+、cY2-、dZ-具有相同的电子层结构,根据“阴上阳下”的原则,W、X在下一周期,Y、Z在上一周期;W带的正电荷比X多,说明W在X的右侧,Y带的负电荷比Z多,说明Y在Z的左侧。A、质子数c<b,错误;B、X、W同周期,W在X的右侧,原子半径X>W,错误;C、Y在Z的左侧,说明Z的非金属性比Y强,所以氢化物的稳定性H2Y<HZ,错误;D、Z的非金属性比Y强,则其阴离子的还原性Y2->Z-,正确,答案选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目




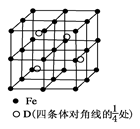
 草酸钠晶体中存在 (填图中元素代号)。
草酸钠晶体中存在 (填图中元素代号)。