题目内容
(15分)(1)碳、氮、氧的第一电离能大小顺序为 ,氧原子电子排布式为 。
(2)氨分子氮原子杂化类型 ,氨水中四种氢键哪一种是主要的 ,规律是什么? 。画出氢氟酸溶液中最主要氢键 。




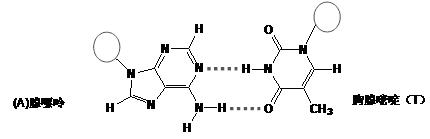
(3)DNA中四种碱基间通过氢键可能的配对方式,用虚线把氢键表示出来
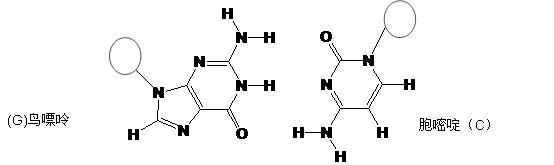
(4)试分析富马酸的K2大于其顺式异构体马来酸K2的原因。

(5)下表是三种火箭推进剂的沸点,为什么火箭推进剂选择氮元素? 。
(6)常压下,水冷却至0 ℃以下,即可结晶成六方晶系的冰。日常生活中见到的冰、霜和雪等都是属于这种结构,其晶胞如下图所示(只显示氧原子,略去氢原子),晶胞参数侧棱c=737 pm,菱形底边a=452 pm,底面菱形的锐角是60°。

回答下列问题:
①计算晶胞中含有几个水分子。 ②计算冰的密度。
(2)氨分子氮原子杂化类型 ,氨水中四种氢键哪一种是主要的 ,规律是什么? 。画出氢氟酸溶液中最主要氢键 。




(3)DNA中四种碱基间通过氢键可能的配对方式,用虚线把氢键表示出来


(4)试分析富马酸的K2大于其顺式异构体马来酸K2的原因。

(5)下表是三种火箭推进剂的沸点,为什么火箭推进剂选择氮元素? 。
| 物质 | H2 | N2H4 | H2NN(CH3)2 |
| 沸点/℃ | -252.8 | 113.5 | ~116 |

回答下列问题:
①计算晶胞中含有几个水分子。 ②计算冰的密度。
(1)氮>氧>碳 1s22s2p4
(2)sp3 D 极性键较强的氢和非金属性较弱的元素间形成氢键 O…H—F
(3)

(4)酸性氢原子参与形成氢键时,其酸性减弱。
(5)形成氢键,火箭载体减去了冷却系统的质量
 (6)①冰晶胞中含有水分子的个数为:
(6)①冰晶胞中含有水分子的个数为:

(2)sp3 D 极性键较强的氢和非金属性较弱的元素间形成氢键 O…H—F
(3)


|
(5)形成氢键,火箭载体减去了冷却系统的质量
 (6)①冰晶胞中含有水分子的个数为:
(6)①冰晶胞中含有水分子的个数为: 
试题分析:(1)一般情况下,元素的原子半径越小,元素的非金属性越强,其电离能就越大。但是由于N原子的最外层电子处于半充满的稳定状态,所以其第一电离能比O大。因此,这三种元素的第一电离能的大小关系为:氮>氧>碳。氧原子电子排布式为1s22s2p4;(2)在氨分子氮原子杂化类型sp3杂化。在氨水中氨分子中的N原子与水分子中的H原子之间形成的氢键是主要的。因此选项为D。规律是极性键较强的氢和非金属性较弱的元素间形成氢键。在氢氟酸溶液中最主要氢键O…H—F。(3)氢键用虚线表示为:
 ;
; 。(4)在富马酸的K2大于其顺式异构体马来酸K2的原因是酸性氢原子参与形成氢键时,其酸性减弱。(5)由三种火箭推进剂的沸点可知:当其组成中含有N元素时,分子之间形成氢键,使物质的沸点较高,火箭载体减去了冷却系统的质量。使火箭的质量更小,发射更容易。①冰晶胞中含有水分子的个数为:
。(4)在富马酸的K2大于其顺式异构体马来酸K2的原因是酸性氢原子参与形成氢键时,其酸性减弱。(5)由三种火箭推进剂的沸点可知:当其组成中含有N元素时,分子之间形成氢键,使物质的沸点较高,火箭载体减去了冷却系统的质量。使火箭的质量更小,发射更容易。①冰晶胞中含有水分子的个数为: ;
;  .
. 
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目