题目内容
【选修3-物质的结构与性质】(15分)

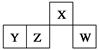
上表为周期表的一部分,其中的编号代表所对应的元素。请回答下列问题:
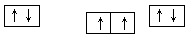
(1)⑨号元素的基态原子的价电子排布式是________,与其同周期,且基态原子的核外未成对电子数最多的元素是______(写出元素符号),②号元素基态原子的电子排布图为___。
(2) ①号与③号元素形成的含有18电子的物质为________(写出名称),②号与③号元素形成的,能造成温室效应的物质的空间构型为________。
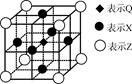
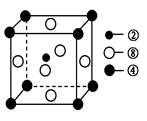
②、④、⑧三种元素的原子形成的晶体,其晶胞的结构特点如图所示,则该化合物的化学式为________(用对应的元素符号表示),常温条件下丙烯是气态,而相对分子质量比丙烯小的甲醇,常温条件下却呈液态,出现这种现象的原因是____________。
(3)①、②两种元素能形成多种平面形分子,其中有一种相对分子质量最小,有关该分子的说法中正确的是________。
a.该分子属于含有极性键的非极性分子b.该分子含有4个σ键和1个π键
c.该分子中的②原子采取sp2杂化d.该物质易溶于水,并能和水反应得到酒精
(4)某元素的价电子排布式为nsnnpn+1,该元素可与元素①形成含有10个电子的分子X,将过量的X通入盛有硫酸铜溶液的试管里,产生的现象为_______。
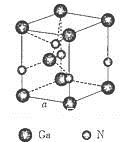
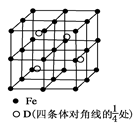
(5) 若D元素与Fe元素形成某种晶体如图所示。若晶胞的边长为a nm,则合金的密度为________g/cm3。

上表为周期表的一部分,其中的编号代表所对应的元素。请回答下列问题:
(1)⑨号元素的基态原子的价电子排布式是________,与其同周期,且基态原子的核外未成对电子数最多的元素是______(写出元素符号),②号元素基态原子的电子排布图为___。
(2) ①号与③号元素形成的含有18电子的物质为________(写出名称),②号与③号元素形成的,能造成温室效应的物质的空间构型为________。
②、④、⑧三种元素的原子形成的晶体,其晶胞的结构特点如图所示,则该化合物的化学式为________(用对应的元素符号表示),常温条件下丙烯是气态,而相对分子质量比丙烯小的甲醇,常温条件下却呈液态,出现这种现象的原因是____________。

(3)①、②两种元素能形成多种平面形分子,其中有一种相对分子质量最小,有关该分子的说法中正确的是________。
a.该分子属于含有极性键的非极性分子b.该分子含有4个σ键和1个π键
c.该分子中的②原子采取sp2杂化d.该物质易溶于水,并能和水反应得到酒精
(4)某元素的价电子排布式为nsnnpn+1,该元素可与元素①形成含有10个电子的分子X,将过量的X通入盛有硫酸铜溶液的试管里,产生的现象为_______。
(5) 若D元素与Fe元素形成某种晶体如图所示。若晶胞的边长为a nm,则合金的密度为________g/cm3。

(1) 3d104s1 (1分) Cr (1分)
(1分)
(2) 过氧化氢 (1分) 直线型 (1分) MgNi3C或Ni3MgC (2分)
甲醇分子间存在氢键,而丙烯分子间只有范德华力 (2分)
(3)ac (2分)
(4)先产生蓝色沉淀,后沉淀消失,溶液变成深蓝色 (2分)
(5 ) 0.92/a3或5.56×1023/(a3NA) (2分)

(1分)
(2) 过氧化氢 (1分) 直线型 (1分) MgNi3C或Ni3MgC (2分)
甲醇分子间存在氢键,而丙烯分子间只有范德华力 (2分)
(3)ac (2分)
(4)先产生蓝色沉淀,后沉淀消失,溶液变成深蓝色 (2分)
(5 ) 0.92/a3或5.56×1023/(a3NA) (2分)
试题分析:(1)⑨号元素为铜元素,基态原子的价电子排布式是3d104s1,与其同周期,且基态原子的核外未成对电子数最多的元素的电子排布式为[Ar]3d54s1是Cr,②号元素为碳元素,基态原子的电子排布图

(2) ①号元素氢与③号元素氧形成的含有18电子的物质为过氧化氢,②号元素碳与③号元 素氧形成的,能造成温室效应的物质二氧化碳的空间构型为直线型。根据晶胞的结构利用切割法判断,1个晶胞中含有1个碳原子,镁原子8×1/8=1个,镍原子6×1/2=3个,C、Mg、Ni三种元素的原子形成的晶体的化学式为MgNi3C或Ni3MgC,常温条件下丙烯是气态,而相对分子质量比丙烯小的甲醇,常温条件下却呈液态,出现这种现象的原因是甲醇分子间存在氢键,而丙烯分子间只有范德华力。
(3)C、H两种元素能形成多种平面形分子,其中有一种相对分子质量最小为 乙炔,a.该分子中碳氢键为极性键,分子结构对称,属于含有极性键的非极性分子,正确;b.该分子含有2个碳氢键和1个碳碳三键,共3个σ键和2个π键,错误;c.该分子为直线型,碳原子采取sp1杂化,错误;d、该物质微溶于水,错误,选a;
(4)某元素的价电子排布式为nsnnpn+1,该元素为氮元素,可与元素氢形成含有10个电子的分子氨气,将过量的氨气通入盛有硫酸铜溶液的试管里,先发生复分解反应后发生络合反应,产生的现象为先产生蓝色沉淀,后沉淀消失,溶液变成深蓝色。
(5) 根据晶胞的结构先确定1个晶胞中含有各原子的个数,进一步确定化学式,结合密度的定义及相关数学知识进行计算。无法确定D元素,无法计算

练习册系列答案
相关题目