题目内容
(8分)A、B、D、E是短周期中构成蛋白质的重要元素,其性质见下表。Fe、Co元素的常见化合价为+2、+3,能形成各种有色配离子。
(1)基态Fe原子的电子排布式为 。
(2)Fe、Co两元素的第三电离能I3(Fe) I3(Co)(填“<”或“>”)。
(3)B、D、E的气态氢化物的沸点由高到低的顺序为 (填化学式)。
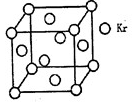
(4)Co与E形成的化合物晶胞如右图所示,则该化合物的化学式为 。(用元素符号表示)
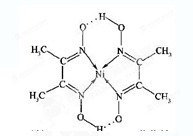
(5)Co的离子能与AD-离子生成各种配合物。紫色的配离子[Co(AD)6]4-是一种相当强的还原剂,在加热时能与水反应生成[Co(AD)6]3-。
①HAD分子中A元素的杂化类型为 ,D元素的化合价为 。
②写出[Co(AD)6]4-在加热时与水反应生成[Co(AD)6]3-的离子方程式: 。
| | A | B | D | E |
| 化合价 | -4 | -2 | -3 | -2 |
| 电负性 | 2.5 | 2.5 | 3.0 | 3.5 |
(2)Fe、Co两元素的第三电离能I3(Fe) I3(Co)(填“<”或“>”)。
(3)B、D、E的气态氢化物的沸点由高到低的顺序为 (填化学式)。
(4)Co与E形成的化合物晶胞如右图所示,则该化合物的化学式为 。(用元素符号表示)

(5)Co的离子能与AD-离子生成各种配合物。紫色的配离子[Co(AD)6]4-是一种相当强的还原剂,在加热时能与水反应生成[Co(AD)6]3-。
①HAD分子中A元素的杂化类型为 ,D元素的化合价为 。
②写出[Co(AD)6]4-在加热时与水反应生成[Co(AD)6]3-的离子方程式: 。
(1)1s22s22p63s23p63d64s2(1分) (2)<(1分)
(3)H2O>NH3>H2S或H2O、NH3、H2S(1分) (4)CoO(1分)
(5)① sp (1分) -3 (1分)
②2[Co(CN)6]4-+2H2O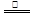 2[Co(CN)6]3-+H2↑+2OH-(2分)
2[Co(CN)6]3-+H2↑+2OH-(2分)
(3)H2O>NH3>H2S或H2O、NH3、H2S(1分) (4)CoO(1分)
(5)① sp (1分) -3 (1分)
②2[Co(CN)6]4-+2H2O
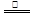 2[Co(CN)6]3-+H2↑+2OH-(2分)
2[Co(CN)6]3-+H2↑+2OH-(2分)(1)根据构造原理可知,基态Fe原子的电子排布式为1s22s22p63s23p63d64s2。
(2)由于亚铁离子失去电子生成铁离子后,3d轨道电子是半充满状态,稳定性强,所以Fe、Co两元素的第三电离能是I3(Fe)>I3(Co)。
(3)根据元素的性质可知,A、B、D、E分别是C、S、N、O。由于水分子和氨气分子间都存在氢键,沸点高,所以气态氢化物的沸点由高到低的顺序为H2O>NH3>H2S。
(4)根据晶胞的结构可知,含有的原子个数分别是12×1/4+1=4、8×1/8+6×1/2=4,所以化学式为CoO.
(5)①HAD分子中氢原子和碳原子形成的单键,氮原子和碳原子形成的是三键,所以是直线型结构,碳原子是sp杂化,氮原子的化合价是-3价。
②[Co(AD)6]4-是一种相当强的还原剂,所以和水反应,水是氧化剂,还原产物是氢气,所以方程式为2[Co(CN)6]4-+2H2O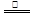 2[Co(CN)6]3-+H2↑+2OH-。
2[Co(CN)6]3-+H2↑+2OH-。
(2)由于亚铁离子失去电子生成铁离子后,3d轨道电子是半充满状态,稳定性强,所以Fe、Co两元素的第三电离能是I3(Fe)>I3(Co)。
(3)根据元素的性质可知,A、B、D、E分别是C、S、N、O。由于水分子和氨气分子间都存在氢键,沸点高,所以气态氢化物的沸点由高到低的顺序为H2O>NH3>H2S。
(4)根据晶胞的结构可知,含有的原子个数分别是12×1/4+1=4、8×1/8+6×1/2=4,所以化学式为CoO.
(5)①HAD分子中氢原子和碳原子形成的单键,氮原子和碳原子形成的是三键,所以是直线型结构,碳原子是sp杂化,氮原子的化合价是-3价。
②[Co(AD)6]4-是一种相当强的还原剂,所以和水反应,水是氧化剂,还原产物是氢气,所以方程式为2[Co(CN)6]4-+2H2O
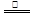 2[Co(CN)6]3-+H2↑+2OH-。
2[Co(CN)6]3-+H2↑+2OH-。
练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目