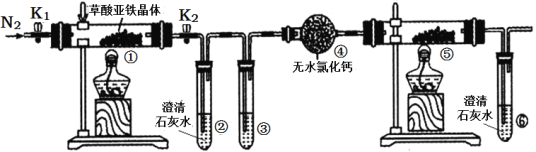
题目内容
【题目】铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒。工业上往往采取下列循环工艺防止铬的污染:
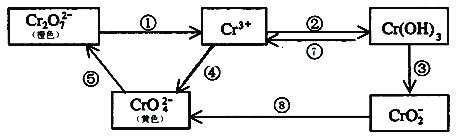
完成下列填空:
(1)①步中含Cr2O![]() 离子的废水在酸性条件下能用Fe3O4处理,反应的离子方程式为_____________;
离子的废水在酸性条件下能用Fe3O4处理,反应的离子方程式为_____________;
(2)反应⑤是可逆反应,在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,写出该反应的离子方程式:___________________________________;
(3)向上述反应后的溶液中加入碱溶液,让废水的pH升至8~10,控制适当的温度,使产物中的金属阳离子全部转变为沉淀。回收所得的Cr(OH)3,经处理后又可转变成K2Cr2O7。纯净的K2Cr2O7常用于准确测定Na2S2O3溶液的物质的量浓度,方法如下:
①Cr2O72-+6I-+14H+ =3I2+2Cr3++7H2O
②2S2O32-+ I2 =S4O62-+2I-,准确称取纯净的K2Cr2O7 0.294g配成溶液,加足量KI,用Na2S2O3溶液滴定,消耗Na2S2O3溶液25.00mL。
①回收所得的Cr(OH)3在处理之前需要先进行洗涤,洗涤沉淀的方法为________________________;
②滴定时加入的指示剂通常为_________,滴定至终点的现象是_______________________________;
③Na2S2O3溶液的物质的量浓度为__________。
【答案】Cr2O![]() +6Fe3O4+62H+=2Cr3++18Fe3++31H2O 2CrO42-+2H+
+6Fe3O4+62H+=2Cr3++18Fe3++31H2O 2CrO42-+2H+![]() Cr2O72-+H2O 沿玻璃棒向漏斗中注入蒸馏水,使蒸馏水完全浸没沉淀,待蒸馏水自然流尽后,重复操作2~3次 淀粉溶液 溶液的颜色由蓝色变为无色,且半分钟内溶液的颜色不再改变 0.2400mol·L-1
Cr2O72-+H2O 沿玻璃棒向漏斗中注入蒸馏水,使蒸馏水完全浸没沉淀,待蒸馏水自然流尽后,重复操作2~3次 淀粉溶液 溶液的颜色由蓝色变为无色,且半分钟内溶液的颜色不再改变 0.2400mol·L-1
【解析】
(1)①将Cr2O72-与Fe3O4反应的离子方程式配平即可;
(2)溶液由黄色逐渐变成橙色,可知是CrO42-与Cr2O72-的相互转化;
(3)①洗涤沉淀的方法为沿玻璃棒向漏斗中注入蒸馏水,使蒸馏水完全浸没沉淀,待蒸馏水自然流尽后,重复操作2~3次;②反应物为碘单质,加入淀粉做指示剂,滴定终点时溶液的颜色由蓝色变为无色,且半分钟内溶液的颜色不再改变;③Na2S2O3溶液的物质的量浓度可结合相关反应方程式进行计算;
(1)反应中Cr2O72-→Cr3+,Cr元素由+6价降为+3价,1molCr2O72-得到6e-,1molFe3O4→Fe3+失去1e-。由得失电子守恒可知,Cr2O72-的系数为1,Fe3O4的系数为6,再根据原子守恒,电荷守恒配平系数,得到离子反应方程式Cr2O72-+6Fe3O4+62H+=2Cr3++18Fe 3++31H2O;
(2)在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,说明黄色的CrO42-离子转化为Cr2O72-离子,该可逆反应的方程式为2CrO42-+2H+![]() Cr2O72-+H2O;
Cr2O72-+H2O;
(3)①洗涤沉淀的方法为沿玻璃棒向漏斗中注入蒸馏水,使蒸馏水完全浸没沉淀,待蒸馏水自然流尽后,重复操作2~3次;②反应时,碘离子被氧化为碘单质,碘遇淀粉溶液变蓝,故滴定时加入的指示剂通常为淀粉溶液;滴定至终点的现象是溶液的颜色由蓝色变为无色,且半分钟内溶液的颜色不再改变;③由Cr2O72-+6I-+14H+ =3I2+2Cr3++7H2O和2S2O32-+ I2 =S4O62-+2I-可知,Cr2O72- ~ 3I2 ~ 6S2O32-。0.294g K2Cr2O7的物质的量n(K2Cr2O7)=0.001mol,故n(Na2S2O3)=0.006mol,消耗Na2S2O3溶液25.00mL,则c(Na2S2O3)=0.2400 mol·L-1

【题目】A、B、C、D四种物质均为下列离子组成的可溶性化合物,组成这四种物质的离子(离子不能重复组合)有:
阳离子 | Na+、Al3+、Ba2+、NH4+ |
阴离子 | Cl-、OH-、CO32-、SO42- |
分别取四种物质进行实验,实验结果如下①B溶液分别与C、D混合,均有白色沉淀生成②将A溶液逐滴滴入C溶液中,有沉淀生成,继续滴加A溶液时,沉淀减少直至完全消失③A与D两种固体混合有气体生成,该气体能使湿润的红色石蕊试液变蓝④用石墨电极电解B溶液,在阳极上产生一种有刺激性气味的气体
回答下列问题:
(1)A所含的阳离子和C所含阳离子的半径大小____>______(填离子符号)。B所含的阴离子是________
(2)C溶液呈___性(填“酸性”或“碱性”),其原因是__________________
(用离子方程式解释)。D的化学式是____________
(3)以Pt为电极电解1L0.1mol/LB的水溶液,当电路中通过0.1mol电子时,
溶液的pH为_______(设电解过程溶液体积不变),阳极的电极反应式为 _____
(4)若将④阳极产生的气体通入A溶液中至恰好完全反应时,则溶液中各离子
浓度由大到小的排列顺序为__________________________