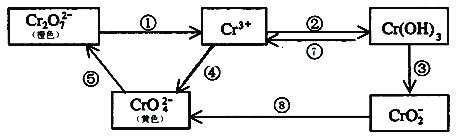
题目内容
【题目】一定条件下,在体积为10L的固定容器中发生的反应:N2+3H2![]() 2NH3,反应过程如下图所示,下列说法正确的是
2NH3,反应过程如下图所示,下列说法正确的是
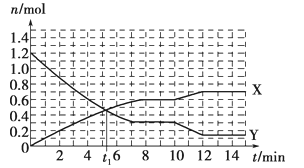
A. t1 min时正、逆反应速率相等
B. X曲线表示NH3的物质的量随时间变化的关系
C. 0~8 min,H2的平均反应速率v(H2)=0.75 mol·L-1·min-1
D. 10~12 min,N2的平均反应速率为v(N2)=0.25mol·L-1·min-1
【答案】B
【解析】试题分析: A、根据该图像,可知平衡时X的物质的量增加0.6mol,Y的物质的量减少1.2-0.3=0.9mol,0.6:0.9=2:3,说明X是氨气,Y是氢气。t1 min时X与Y的物质的量相等,但未达平衡,所以正逆反应的速率不相等,A项错误;B、X曲线表示NH3的物质的量随时间变化的关系,B项正确;C、根据A的分析可知X是氨气,正确;C、0~8 min,H2的平均反应速率v(H2)=(1.2-0.3)mol/10L/8min="0.0125" mol·L-1·min-1,C项错误;D、10~12 min,H2的平均反应速率为v(H2)=(0.3-0.15)/10L/2min="0.0075" mol·L-1·min-1,氮气的反应速率是氢气反应速率的1/3,则N2的平均反应速率为v(N2)=" 0.0075" mol·L-1·min-1/3="0.0025" mol·L-1·min-1,D项错误;答案选B。

 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案【题目】利用下图装置测定中和热的实验步骤如下:

①用量筒量取50 mL 0.25 mol·L-1硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)倒入NaOH溶液的正确操作是__________。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使硫酸与NaOH溶液混合均匀的正确操作是________。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(3)搅拌棒为何不用铜质的_____________.
(4)实验数据如下表:
①请填写下表中的空白:________。
温度 实验次数 | 起始温度 | 终止温度
| 温度差平均值 | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似认为0.55 mol·L-1NaOH溶液和0.25 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。依据上表数据计算中和热ΔH=________(取小数点后一位)。
③中和热测定实验中,下列操作一定会降低实验准确性的是______。
A.滴定管(精量仪器,读数保留到0.01)取所用酸碱溶液的体积
B.NaOH溶液在倒入小烧杯时,有少量溅出
C.大、小烧杯体积相差较大,夹层间放的碎泡沫塑料较多
D.测量硫酸溶液的温度计用水洗净后才用来测NaOH溶液的温度