题目内容
【题目】从煤和石油中可以提炼出化工原料A和B,A是一种果实促熟剂,它的产量用来衡量一个国家的石油化工发展水平。B是一种比水轻的油状液体,B仅由碳、氢两种元素组成,碳元素与氢元素的质量比为12∶1,B的相对分子质量为78。回答下列问题:
(1)A的电子式为____________________,A的结构简式为____________________。
(2)A可以使溴的四氯化碳溶液褪色的化学反应方程式为: _________,反应类型为__________。
(3)在碘水中加入B振荡静置后的现象为___________________。
(4)B与浓硫酸和浓硝酸在50~60℃反应的化学反应方程式为: ___________,反应类型为__________。
(5)等质量的A、B完全燃烧时消耗O2的物质的量__________(填"A>B""A<B"或"A=B")。
【答案】![]() CH2=CH2 CH2=CH2+Br2→CH2BrCH2Br 加成反应 分层,下层无色,上层紫红色
CH2=CH2 CH2=CH2+Br2→CH2BrCH2Br 加成反应 分层,下层无色,上层紫红色 ![]() 取代反应(或硝化反应) A>B
取代反应(或硝化反应) A>B
【解析】
A是一种果实促熟剂,它的产量用来衡量一个国家的石油化工发展水平,则A为CH2=CH2,B是一种比水轻的油状液体,B仅由碳氢两种元素组成,碳元素与氢元素的质量比为12∶1,则原子个数之比为1∶1,B的相对分子质量为78,则12n+2n-6=78,解得n=6,所以B为苯,结合乙烯和苯的结构与性质分析解答。
(1)A为CH2=CH2,其电子式为![]() ,结构式为
,结构式为![]() ,结构简式为CH2=CH2,故答案为:
,结构简式为CH2=CH2,故答案为:![]() ;CH2=CH2;
;CH2=CH2;
(2)乙烯含有碳碳双键,能够与溴发生加成反应,使溴水褪色,反应的化学方程式为CH2=CH2+Br2→CH2BrCH2Br,故答案为:CH2=CH2+Br2→CH2BrCH2Br;加成反应;
(3)碘水中加入苯发生萃取,苯的密度比水的小,则苯在上层,上层为紫红色,水在下层,下层为无色,故答案为:分层,下层无色,上层紫红色;
(4)B与浓H2SO4与浓HNO3在50-60℃发生硝化反应,反应的化学反应方程![]() ,属于取代反应(或硝化反应),故答案为:
,属于取代反应(或硝化反应),故答案为:![]() ;取代反应(或硝化反应);
;取代反应(或硝化反应);
(5)设A、B的质量都为mg,由CxHy消耗x+![]() 氧气,可知等质量的A、B完全燃烧时消耗O2的物质的量分别为
氧气,可知等质量的A、B完全燃烧时消耗O2的物质的量分别为![]() ×(2+
×(2+![]() )=
)=![]() mol和
mol和![]() ×(6+
×(6+![]() )=
)=![]() mol,所以等质量的A、B完全燃烧时消耗O2的物质的量A>B,故答案为:A>B。
mol,所以等质量的A、B完全燃烧时消耗O2的物质的量A>B,故答案为:A>B。

 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案【题目】氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。回答下列问题:
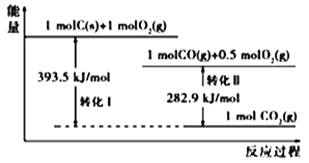
已知:2C(s)+O2(g)=2CO(g) ΔH=- 221 kJ/mol
C(s)+O2(g)=CO2(g) △H=- 393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ΔH= +181 kJ/mol
(1)若某反应的平衡常数表达式为K=![]() ,请写出此反应的热化学方程式:___________________________;下列措施能够增大此反应中NO的转化率的是(填字母代号)_________。
,请写出此反应的热化学方程式:___________________________;下列措施能够增大此反应中NO的转化率的是(填字母代号)_________。
a.增大容器压强 b.升高温度 c.使用优质催化剂 d.增大CO的浓度
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
物质的量/mol | T1/℃ | T2/℃ | |||||
0 | 5 min | 10 min | 15 min | 20 min | 15 min | 30 min | |
NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
①0~5min内,以CO2表示的该反应速率v(CO2)=_____,该条件下的平衡常数K=__________。
②第15 min后,温度调整到T2,数据变化如上表所示,则T1_______ T2(填“>”、“<”或“=”)。
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,则此时反应_______移动(填“正向”、“逆向”或“不”);最终达平衡时NO的转化率a=______________。
【题目】采用N2O5为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用。回答下列问题
(1)1840年 Devil用干燥的氯气通过干燥的硝酸银,得到N2O5。该反应的氧化产物是一种气体,其分子式为___________。
(2)F. Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:

其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示(t=∞时,N2O5(g)完全分解):
t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
p/kPa | 35.8 | 40.3 | 42.5. | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
①已知:2N2O5(g)=2N2O4(g)+O2(g) ΔH1=4.4 kJ·mol1 ,2NO2(g)=N2O4(g) ΔH 2=55.3 kJ·mol1,则反应N2O5(g)=2NO2(g)+1/2O2(g)的ΔH =_______ kJ·mol1。
②研究表明,N2O5(g)分解的反应速率v=2×10-3×P(N2O5)(KPa/min)。t=62 min时,测得体系中P(O2)=2.9 kPa,则此时的P(N2O5)=________ kPa,v=_______kPa·min1。
③若提高反应温度至35℃,则N2O5(g)完全分解后体系压强p∞(35℃)____63.1 kPa(填“大于”“等于”或“小于”)。
④25℃时N2O4(g)![]() 2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
(3)对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:
第一步 N2O5![]() NO2+NO3 快速平衡
NO2+NO3 快速平衡
第二步 NO2+NO3→NO+NO2+O2 慢反应
第三步 NO+NO3→2NO2 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是_______(填标号)。
A.v(第一步的逆反应)>v(第二步反应) B.反应的中间产物只有NO3
C.第二步中NO2与NO3的碰撞仅部分有效 D.第三步反应活化能较高