题目内容
已知A(g)+B(g)  C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/℃ | 700 | 900 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1) 830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)="0.003" mol·L-1·s-1,则6s时c(A)=________mol·L-1, C的物质的量为______ mol;此时,正反应速率_____________(填“大于”、“小于”或“等于”)逆反应速率。
(2)在恒容密闭容器中判断该反应是否达到平衡的依据为________(填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c. c(A)不随时间改变 d.单位时间里生成c和D的物质的量相等
(3)1200℃时反应C(g)+D(g)
 A(g)+B(g)的平衡常数的值为___________________。
A(g)+B(g)的平衡常数的值为___________________。(4)绝热容器不与外界交换能量,在恒容绝热条件下,进行2M(g)+N(g)
 2P(g)+Q(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高,简述该反应的平衡常数与温度的变化关系:__________________________________________________________________________________。
2P(g)+Q(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高,简述该反应的平衡常数与温度的变化关系:__________________________________________________________________________________。| 物 质 | M | N | P | Q |
| 起始投料/mol | 2 | 1 | 2 | 0 |
(本题共8分)(1)0.022 mol·L-1 0.09mol 大于 (3分) (2)c (2分)
(3)2.5 (1分) (4)该反应的平衡常数随温度的升高而减小(2分)
解析试题分析:(1)6s内A的平均反应速率v(A)=0.003mol?L-1?s-1,则△c(A)=0.003mol?L-1?s-1×6s=0.018mol?L-1,故6s时A的浓度为0.2mol÷5L-0.018mol/L=0.022mol/L。△n(A)=0.018mol?L-1×5L=0.09mol,由方程式可知△n(C)=△n(A)=0.09mol
利用三段式计算平衡时各组分的物质的量,即
A(g)+B(g) C(g)+D(g)
C(g)+D(g)
起始量(mol) 0.2 0.8 0 0
转化量(mol) 0.09 0.09 0.09 0.09
6s时(mol) 0.11 0.71 0.09 0.09
由于反应前后体积不变,所以浓度商Qc=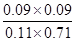 <1
<1
所以反应向正反应进行,故正反应速率大于逆反应速率
(2)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。a.该反应前后气体的物质的量不变,压强始终不变,故压强不随时间改变,不能说明到达平衡,故a错误;b.该反应前后气体的体积不变,混合气体的质量不变,气体的密度始终不变,故b错误;c.可逆反应到达平衡时,各物质的浓度不变,故c(A)不随时间改变,说明到达平衡,故c正确;d.单位时间里生成C和D的物质的量相等,都表示正反应速率,反应始终按1:1生成,不能说明到达平衡,故d错误,答案选c。
(3)同一温度下,同一反应的正、逆反应的平衡常数互为倒数,故1200℃时反应C(g)+D(g) A(g)+B(g)的平衡常数的值为
A(g)+B(g)的平衡常数的值为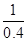 =2.5。
=2.5。
(4)由起始Q的物质的量为0可知,反应向正反应进行建立平衡,正反应是气体体积减小的反应,容器的体积不变,平衡时压强增大,故绝热条件下,混合气体的温度升高,即正反应为放热反应,升高温度平衡向逆反应进行,化学平衡常数减小,即该反应的平衡常数与温度的变化关系该反应的平衡常数随温度的升高而减小。
考点:考查反应速率、平衡常数的计算;外界条件对平衡状态的影响等

 名校练考卷期末冲刺卷系列答案
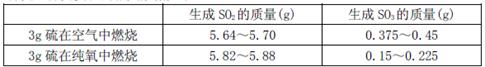
名校练考卷期末冲刺卷系列答案 (12分)工业制硫酸时,利用接触氧化反应将SO2转化为SO3是一个关键的步骤。
(1)在接触室中2SO2(g)+O2(g)  2SO3(g)达到平衡状态的标志是______。
2SO3(g)达到平衡状态的标志是______。
| A.υ(O2)正=2υ(SO2)逆 |
| B.容器中气体的总质量不随时间而变化 |
| C.容器中气体的颜色不随时间而变化 |
| D.容器中气体的压强不随时间而变化 |
 2SO3(g) ΔH<0。下列图像中不正确的是______ (填字母序号)。
2SO3(g) ΔH<0。下列图像中不正确的是______ (填字母序号)。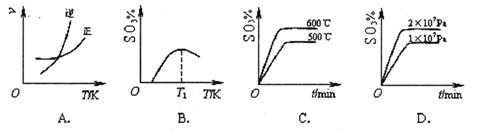
(3)某温度下SO2(g)+
 O2(g)
O2(g)  SO3(g) ΔH=-98KJ/mol
SO3(g) ΔH=-98KJ/mol①开始时在体积固定的密闭容器中加入4mol SO2 (g)和1mol O2 (g),达到平衡时 共放出196 KJ的热量,该温度下SO2的平衡转化率为______
②已知固态单质硫的燃烧热为296KJ/mol,则由S(s)生成2 molSO3(g)的ΔH为____________
(4)检验SO42-常用BaCl2溶液。常温时,BaSO4的Ksp=1.08×10-10,现将等体积的BaCl2溶液与2.0×10-3mol/L的H2SO4溶液混合。若要生成BaSO4沉淀,原BaCl2溶液的最小浓度为____________
一定温度下,向1.0L密闭容器中加入0.60molX(g),发生反应X(g)  Y(s)+2Z(g)△H>0测得反应物X浓度与反应时间的数据如下表
Y(s)+2Z(g)△H>0测得反应物X浓度与反应时间的数据如下表
| 反应时间t/min | 0 | 1 | 2 | 3 | 4 | 6 | 8 |
| c(X)/(mol·L-1) | 0.60 | 0.42 | 0.30 | 0.21 | 0.15 | a | 0.0375 |
(1)3min时用Z表示的平均反应速率v(Z)= 。
(2)分析该反应中反应物的浓度与时间的规律,得出的结论是 。由此规律推出反应在6min时反应物的浓度a为 mol·L-1。
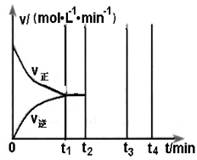
(3)反应的逆反应速率随时间变化的关系如图,t2时改变了某一种条件,改变的条件可能是 、 (填写两顶)
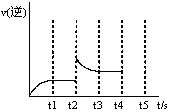
(4)下列哪些情况表明容器中已达平衡状态 (填字母序号)
A.容器体积一定时气体密度不再变化
B.反应的平衡常数不再变化
C.容器中气体的平均相对分子质量不随时间而变化
D.Y的物质的量不再发生变化
E.Z的生成速率等于X的消耗速率的2倍
 CO2(g)+ H2(g),已知CO(g)和H2O(g)的起始浓度均为2 mol·L-1,经测定该反应在该温度下的平衡常数K =1,试判断:
CO2(g)+ H2(g),已知CO(g)和H2O(g)的起始浓度均为2 mol·L-1,经测定该反应在该温度下的平衡常数K =1,试判断: 反应过程中能量示意图。
反应过程中能量示意图。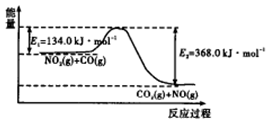

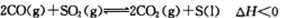 可以实现燃煤烟气中硫的回收。某研究小组向2L某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中通入CO和SO2,10分钟后测得容器CO2的物质的量为0.9mol。
可以实现燃煤烟气中硫的回收。某研究小组向2L某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中通入CO和SO2,10分钟后测得容器CO2的物质的量为0.9mol。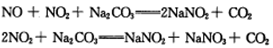

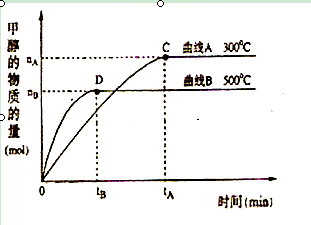
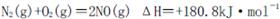 是导致汽车尾 气中含有NO的重要原因之一。
是导致汽车尾 气中含有NO的重要原因之一。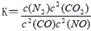 ,此反应为放热反应。在一定温度下,10L某密闭容器中发生上述反应,各物质的物质的量的变化情况如下表
,此反应为放热反应。在一定温度下,10L某密闭容器中发生上述反应,各物质的物质的量的变化情况如下表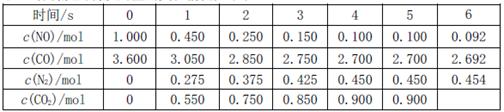
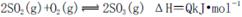 向右移动
向右移动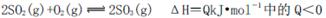
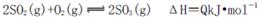 向右移动
向右移动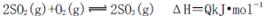 向右移动
向右移动 3C(g),2分钟达到平衡,生成1.5 mol
3C(g),2分钟达到平衡,生成1.5 mol