题目内容
(12分)工业制硫酸时,利用接触氧化反应将SO2转化为SO3是一个关键的步骤。
(1)在接触室中2SO2(g)+O2(g)  2SO3(g)达到平衡状态的标志是______。
2SO3(g)达到平衡状态的标志是______。
| A.υ(O2)正=2υ(SO2)逆 |
| B.容器中气体的总质量不随时间而变化 |
| C.容器中气体的颜色不随时间而变化 |
| D.容器中气体的压强不随时间而变化 |
 2SO3(g) ΔH<0。下列图像中不正确的是______ (填字母序号)。
2SO3(g) ΔH<0。下列图像中不正确的是______ (填字母序号)。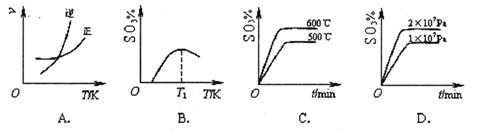
(3)某温度下SO2(g)+
 O2(g)
O2(g)  SO3(g) ΔH=-98KJ/mol
SO3(g) ΔH=-98KJ/mol①开始时在体积固定的密闭容器中加入4mol SO2 (g)和1mol O2 (g),达到平衡时 共放出196 KJ的热量,该温度下SO2的平衡转化率为______
②已知固态单质硫的燃烧热为296KJ/mol,则由S(s)生成2 molSO3(g)的ΔH为____________
(4)检验SO42-常用BaCl2溶液。常温时,BaSO4的Ksp=1.08×10-10,现将等体积的BaCl2溶液与2.0×10-3mol/L的H2SO4溶液混合。若要生成BaSO4沉淀,原BaCl2溶液的最小浓度为____________
(12分)
(1)D (2分)
(2)C (2分)
(3)①50% (2分) ②-788KJ/mol (3分)
(4)2.16×10-7mol/L (3分)
解析试题分析:
(1)平衡状态的为正反应速率等于你反应速率,各组分的量保持不变即达到平衡状态,A、正逆反应速率不相等,不能说明;根据质量守恒,整个反应过程中质量、颜色均不变化,不能说明,BC错误;D、反应过程中压强减小,压强不变说明达到平衡状态,正确。
(2)A、温度升高,正逆反应速率同时增大,平衡逆向移动,正确;B、温度升高平衡逆向移动,正确;C、温度升高速率加快,平衡逆向移动,正确;D压强越大,速率越快,增大压强,平衡正向移动,SO3%减小。
(3)①根据比例,放出196KJ的能量,反应SO22mol,故转化率为50%;
②根据盖斯定律计算可以得到,该反应的反应热为-788KJ/mol;
(4)离子浓度计算按混合后的进行计算,c(Ba2+)= =
=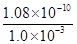 =1.08×10-7mol/L,混合前的弄得为2.16×10-7mol/L。
=1.08×10-7mol/L,混合前的弄得为2.16×10-7mol/L。
考点:本题考查平衡基础知识,涉及化学平衡状态的判断,化学平衡图像,化学平衡计算,沉淀溶解平衡计算等相关知识。

甲醇是重要的化工原料和清洁液体燃料。工业上可利用CO或CO2来生产甲醇。甲醇制
备的相关信息如下表: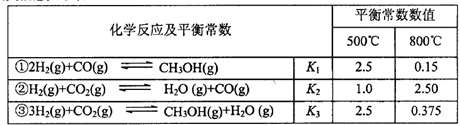
(1)反应②是____反应(选填“吸热”“放热”)。
(2)据上表信息推导出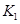 、
、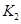 与
与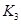 之间的关系,
之间的关系,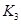 =______用
=______用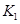 、
、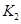 表示)。500℃时测得反应③在某时刻,
表示)。500℃时测得反应③在某时刻,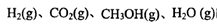 的浓度(mol/L)分别为0 8、0.1、0 3、0 15,此时
的浓度(mol/L)分别为0 8、0.1、0 3、0 15,此时 (选填“>”“<”“=”)。
(选填“>”“<”“=”)。
(3)若某温度下反应①从开始到平衡CO和CH3OH的浓度变化如图一所示,则用H2浓度变化表示此段时间内该反应的平均速.v(H2)= 若某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图二所示,则平衡状态由A变到B时,平衡常数 (选填“>”“<”“=”)。
(选填“>”“<”“=”)。
(4)一定温度下,在体积固定的密闭容器中发生反应②,可判断该反应已经达到平衡的是____。(用相应字母表示)
| A.容器中总压强不变 |
| B.混台气体的平均摩尔质量也始终保持不变, |
| C.混合气体的密度不变 |
| D.CO2(g)或CO(g)的浓度不变 |
已知A(g)+B(g)  C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/℃ | 700 | 900 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1) 830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)="0.003" mol·L-1·s-1,则6s时c(A)=________mol·L-1, C的物质的量为______ mol;此时,正反应速率_____________(填“大于”、“小于”或“等于”)逆反应速率。
(2)在恒容密闭容器中判断该反应是否达到平衡的依据为________(填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c. c(A)不随时间改变 d.单位时间里生成c和D的物质的量相等
(3)1200℃时反应C(g)+D(g)
 A(g)+B(g)的平衡常数的值为___________________。
A(g)+B(g)的平衡常数的值为___________________。(4)绝热容器不与外界交换能量,在恒容绝热条件下,进行2M(g)+N(g)
 2P(g)+Q(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高,简述该反应的平衡常数与温度的变化关系:__________________________________________________________________________________。
2P(g)+Q(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高,简述该反应的平衡常数与温度的变化关系:__________________________________________________________________________________。| 物 质 | M | N | P | Q |
| 起始投料/mol | 2 | 1 | 2 | 0 |
(1)常温下,将2种一元酸分别和NaOH溶液等体积混合,实验数据如下:
| 组别 | 一元酸 | NaOH | pH |
| 甲 | c(HX)=0.1mol/L | c(NaOH)=0.1mol/L | pH=9 |
| 乙 | c(HY)=c1mol/L | c(NaOH)=0.1mol/L | pH=7 |
①甲组实验的混合溶液中离子浓度由大到小顺序为 。由水电离出的c(OHˉ)= mol/L。
②乙组实验中HY为强酸,则HY溶液的c1 (填“<”、“=”或“>”)0.1。
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况和n(NO)/n(CO)比例变化情况如下图。
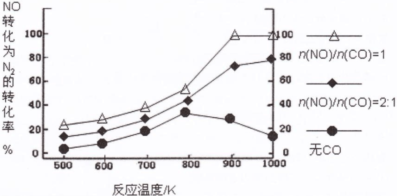
①为达到NO转化为N2的最佳转化率,应该选用的温度和n(NO)/n(CO)比例分别为 、 。
②用CxHy(烃)催化还原NOx也可消除氮氧化物生成无污染的物质。CH4与NO2发生反应的化学方程式为 。
(3)工业上一般在恒容密闭容器中采用下列反应合成甲醇:
CO(g) + 2H2(g)
 CH3OH(g) △H
CH3OH(g) △H下表所列数据是该反应在不同温度下的化学平衡常数(K)。
| 温度 | 523K | 573K | 623K |
| 平衡常数(K) | 2.041 | 0.270 | 0.012 |
①由表中数据判断△H 0(填“<”、“=”或“>”)。
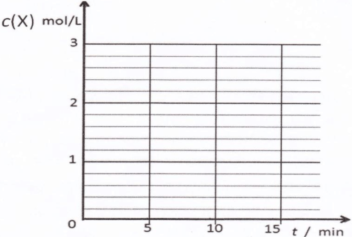
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol/L,则此时的温度为 。
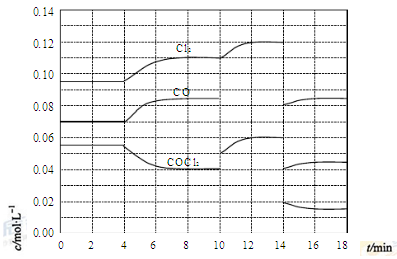
③请在下列坐标中画出②中求得该温度下CO、H2和CH3OH的浓度随时间变化的曲线,并进行适当的标注。
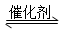 CH3CH2OH(g)+3H2O(g) -Q(Q>0)
CH3CH2OH(g)+3H2O(g) -Q(Q>0)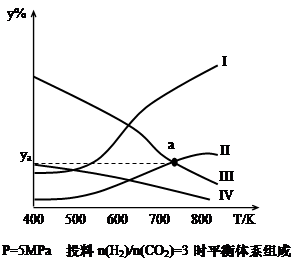
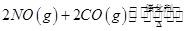
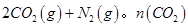 随温度(T)、压强(P)和时间(t)的变化曲线如图所示。请回答下列问题:
随温度(T)、压强(P)和时间(t)的变化曲线如图所示。请回答下列问题: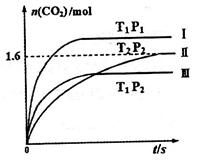
 、
、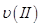 、
、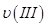 ,则三者大小关系为______________。
,则三者大小关系为______________。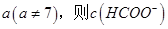 ________
________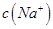 (填“>”、“=”或“<”),则HCOO-的水解平衡常数(Kh)可近似表示为______________(用含a的代数式表示)。
(填“>”、“=”或“<”),则HCOO-的水解平衡常数(Kh)可近似表示为______________(用含a的代数式表示)。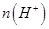 b.
b.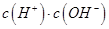 c.
c.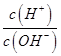 d.
d.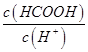
 7N2(g)+12H2O(g)+Q(Q>0)。
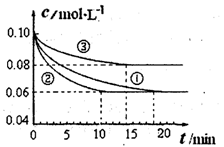
7N2(g)+12H2O(g)+Q(Q>0)。 2NH3(g) △H<0的模拟研究,在1L密闭容器中,分别加入0.1mol N2和0.3mol H2。实验①、②、③中c(N2)随时间(t)的变化如图所示。
2NH3(g) △H<0的模拟研究,在1L密闭容器中,分别加入0.1mol N2和0.3mol H2。实验①、②、③中c(N2)随时间(t)的变化如图所示。