题目内容
在一固定容积为2 L的密闭容器中加入2 molA和3 molB,保持温度为30℃,在
催化剂存在的条件下进行下列反应:2A(g)+3B(g)  3C(g),2分钟达到平衡,生成1.5 mol
3C(g),2分钟达到平衡,生成1.5 mol
C,此时,平衡混合气中C的体积分数为ω1;若将温度升高到70℃后,其他条件均不变,当
反应重新达到平衡时,C的物质的量为2.1 mol,体积分数为ω2,请回答下列问题,
(1)该反应在30℃时平衡常数K1= ,焓变△H 0(填“>”、“<”或“=”)。
(2)该反应在30℃时平衡混合气中C的体积分数为ω1= ;从反应开始到达到化学平衡状态时v(A)=____________mol/(L·min)
(3)该反应在70℃时平衡常数为K2,则 K1 K2(填“>”、“=”或“<”)
(4)70℃时,若保持温度不变,在2 L的密闭容器中加入4 molA和6 molB,当反应重新达到平衡时,C的体积分数为ω3,则ω3 ω2 (填“>”、“<”或“="”" )。
(5)可以判断2A(g)+3B(g)  3C(g) 反应已经达到平衡的是( )
3C(g) 反应已经达到平衡的是( )
A.2v(B)=3v(A)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.混合气体的平均相对分子质量不再改变
E.n(A)∶n(B)∶n(C)=2∶3∶3
(共14分每空二分)(1)4 > (2)37.5% 0.25 (3)< (4)> (5)BD
解析试题分析:(1)2min达平衡,平衡时C为1.5mol,浓度为1.5mol÷2L=0.75mol/L,则:
2A(g)+3B(g) 3C(g)
3C(g)
起始浓度(mol/L) 1 1.5 0
转化浓度(mol/L) 0.5 0.75 0.75
平衡浓度(mol/L) 0.5 0.75 0.75
所以30℃平衡常数k= =4
=4
由题意可知,升高温度平衡时C的物质的量增大,说明升高温度平衡向正反应移动,故正反应为吸热反应,即△H>0
(2)30℃时平衡时C的物质的量为1.5mol,则:
2A(g)+3B(g) 3C(g)物质的量减少△n
3C(g)物质的量减少△n
3 2
1.5mol 1mol
因此平衡时反应混合物总的物质的量为2mol+3mol-1mol=4mol
则C的体积分数ω1=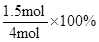 =37.5%
=37.5%
v(C)=0.75mol/L÷2min=0.375mol/(L?min)
由于率之比等于化学计量数之比
所以v(A)=2/3v(C)=2/3×0.375mol/(L?min)=0.25mol/(L?min)。
(3)升高温度平衡向正反应方向移动,说明温度越高平衡常数越大,故K1<K2。
(4)该平衡相当于是在原平衡在70℃到达平衡的基础上压强增大一倍,平衡向正反应方向移动,C的体积分数增大,故ω3>ω2。
(5)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。A中未指明正逆速率,不能说明到达平衡,故A错误;随反应进行,反应混合物的物质的量减小,压强降低,密闭容器中总压强不变,说明到达平衡,故B正确;密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,C不正确;混合气体的总质量不变,随反应进行,反应混合物的物质的量减小,混合气体的平均相对分子质量减小,当混合气体的平均相对分子质量不再改变,说明到达平衡,故D正确;平衡时各组分的物质的量之比不一定等于化学计量数之比,与开始的物质的量及转化率有关,当n(A):n(B):n(C)=2:3:3,不能说明到达平衡,故E错误,因此正确的答案选BD。
考点:考查化学平衡的有关计算、化学平衡常数、平衡状态的判断、反应速率的计算等
点评:该题是高考中的常见题型,属于中等难度的试题。题目综合性较大,对学生的要求较高,有利于调动学生的学习兴趣、激发学生的学习积极性。答题时注意基础知识的理解掌握,难点是等效平衡的应用和平衡状态的判断。

 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案在2L密闭容器内,800℃时反应:2NO(g)+O2(g)  2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K= 。
已知:
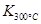 >
>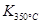 ,则该反应是 热反应。
,则该反应是 热反应。(2)图中表示NO2的变化的曲线是 。用O2表示从0~2 s内该反应的平均速率v= 。
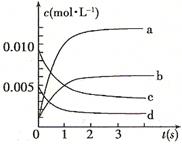
(3)能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动是 。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
已知A(g)+B(g)  C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/℃ | 700 | 900 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1) 830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)="0.003" mol·L-1·s-1,则6s时c(A)=________mol·L-1, C的物质的量为______ mol;此时,正反应速率_____________(填“大于”、“小于”或“等于”)逆反应速率。
(2)在恒容密闭容器中判断该反应是否达到平衡的依据为________(填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c. c(A)不随时间改变 d.单位时间里生成c和D的物质的量相等
(3)1200℃时反应C(g)+D(g)
 A(g)+B(g)的平衡常数的值为___________________。
A(g)+B(g)的平衡常数的值为___________________。(4)绝热容器不与外界交换能量,在恒容绝热条件下,进行2M(g)+N(g)
 2P(g)+Q(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高,简述该反应的平衡常数与温度的变化关系:__________________________________________________________________________________。
2P(g)+Q(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高,简述该反应的平衡常数与温度的变化关系:__________________________________________________________________________________。| 物 质 | M | N | P | Q |
| 起始投料/mol | 2 | 1 | 2 | 0 |
(19分)钒有金属“维生素”之称,研究发现钒的某些化合物对治疗糖尿病有很好的疗效。
工业上设计将VOSO4中的K2SO4、SiO2、CuO杂质除去并回收得到V2O5的流程如下:
请回答下列问题:
(1)步骤②、③的变化过程可表示为(HM为有机萃取剂):
VOSO4 (水层)+ 2HM(有机层) VOM2(有机层) + H2SO4 (水层)
VOM2(有机层) + H2SO4 (水层)
步骤②中萃取时必须加入适量碱,其原因是 。
步骤③中X试剂为 。
(2)步骤④的离子方程式为
(3)该工艺流程中,可以循环利用的物质有 和 。
(4)操作Ⅰ得到的废渣,用 溶解,充分反应后, ,(填写系列操作名称)称量得到mg氧化铜。
(5)为了制得氨水,甲、乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中。
| | 实验装置 | 实验药品 | 制备原理 |
| 甲小组 | A | 氢氧化钙、氯化铵 | 反应的化学方程式为① |
| 乙小组 | ② | 浓氨水、氢氧化钠固体 | 分析产生氨气的原因③ |
某课外兴趣小组对H2O2的分解速率做了如下实验探究。
⑴ 下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2制取150mLO2所需的时间(秒)
① 该小组在设计方案时,考虑了浓度、a: 、b: 等因素对过氧化氢分解速率的影响。
② 从上述影响H2O2分解速率的因素a和b中任选一个,说明该因素对该反应速率的影响:
。
⑵ 将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木
条测试。测定结果如下:
| 催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5分钟 |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
① 写出H2O2发生的化学反应方程式 _______________ ______。
② 实验结果说明催化剂作用的大小与________ _________有关。
 2C(g),若经 2 s(秒)后测得C 的浓度为 0.6 mol·L-1 ,则:① 用物质 A 表示的反应的平均速率 ② 2 s 时物质 B 的浓度为 。
2C(g),若经 2 s(秒)后测得C 的浓度为 0.6 mol·L-1 ,则:① 用物质 A 表示的反应的平均速率 ② 2 s 时物质 B 的浓度为 。 2NH3(g) △H<0的模拟研究,在1L密闭容器中,分别加入0.1mol N2和0.3mol H2。实验①、②、③中c(N2)随时间(t)的变化如图所示。
2NH3(g) △H<0的模拟研究,在1L密闭容器中,分别加入0.1mol N2和0.3mol H2。实验①、②、③中c(N2)随时间(t)的变化如图所示。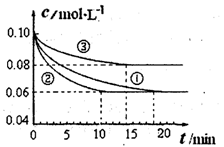
 CO2(g)+H2(g)
CO2(g)+H2(g)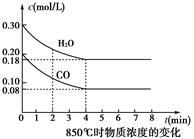
 2SO3(g);
2SO3(g);