题目内容
一定温度下的密闭容器中存在如下反应:
CO(g)+H2O(g) CO2(g)+ H2(g),已知CO(g)和H2O(g)的起始浓度均为2 mol·L-1,经测定该反应在该温度下的平衡常数K =1,试判断:
CO2(g)+ H2(g),已知CO(g)和H2O(g)的起始浓度均为2 mol·L-1,经测定该反应在该温度下的平衡常数K =1,试判断:
(1)当CO转化率为25%时,该反应是否达到平衡_______,若未达到平衡,向哪个方向进行______。
(2)达到平衡时,CO的转化率____________________。
(3)当CO的起始浓度仍为2 mol·L-1,H2O(g)的起始浓度为6 mol·L-1,求平衡时CO的转化率_______。
(1)反应未达平衡 Q=1∕9<K=1,平衡向正反应方向进行。(2)50℅ (3) 75℅。
解析试题分析:(1)当CO转化率为25%时则{C(CO2)C(H2)}∕{C(CO)C(H2O)}=(0.5×0.5)∕(1.5×1.5)=1∕9<1.所以反应未达到平衡。反应向正反应方向进行。当反应达到平衡时,假设消耗的CO浓度为x,根据反应方程式中各物质的关系可得X2∕(2-X)2=1.解得X="1," CO转化率为(1∕2)×100℅=50℅。(3)假设在这种条件下,达到平衡时CO消耗了a mol·L-1,则平衡时各物质的浓度为C(CO)=(2- a)mol·L-1 C(H2O)=(6-a)mol·L-1C(CO2)=amol·L-1C(H2)=amol·L-1. a2∕{(2- a)×(6-a)}=1解得a=1.5.所以CO的转化率为: (1.5∕2) ×100℅=75℅。
考点:考查化学平衡的判断及反应物转化率的计算等的知识。

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案某研究小组对一元有机弱酸HA在溶剂苯和水的混合体系中的溶解程度进行研究。在25℃时,弱酸HA在水中部分电离,当HA浓度为 时,其电离度为0.20(电离度=已电离的HA分子数/起始HA的总分子数);在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;其他信息如下:
时,其电离度为0.20(电离度=已电离的HA分子数/起始HA的总分子数);在苯中部分发生双聚,生成(HA)2。该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=C(HA)B/C(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;其他信息如下:
| 25℃平衡体系 | 平衡常数 | 焓变 | 起始总浓度 |
在水中,HA 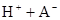 | 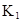 | 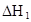 |  |
在苯中,2HA 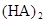 | 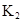 | 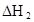 | 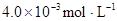 |
回答下列问题:
(1)计算25℃时水溶液中HA的电离平衡常数K1=___________。
(2)25℃,该水溶液的pH为___________,(已知:1g2=0.3,lg3=0.5)在苯体系中HA的转化率为___________。
(3)在苯中,HA发生二聚:2HA
 (HA)2,反应在较低温度下自发进行,则
(HA)2,反应在较低温度下自发进行,则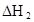 ___________0。
___________0。(4)25℃混合体系中,HA在苯中发生二聚,若测得某时刻溶液中微粒浓度满足
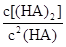 =130,则反应向___________方向进行。
=130,则反应向___________方向进行。 为减少污染,常将煤转化为清洁气体燃料,可将焦炭与水蒸气反应转化为氢气和一氧化碳:C(s)+ H2O(g)  H2(g)+ CO(g)
H2(g)+ CO(g) 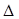 H>0。现在容积固定为2L密闭容器中,加入2mol C(s)和2mol H2O(g),在T℃下充分反应,半分钟后达到平衡,测得H2为0.75mol。
H>0。现在容积固定为2L密闭容器中,加入2mol C(s)和2mol H2O(g),在T℃下充分反应,半分钟后达到平衡,测得H2为0.75mol。
(1)用H2O(g)表示反应开始到达到平衡的平均速率 ;
(2)计算T℃下该反应的平衡常数K= ;若温度升高,则反应平衡常数将 (填“增大”“减小”或“不变”)。
(3)上述条件下该反应达到平衡状态,下列说法正确的是
| A.缩小容器体积,平衡向左移动 | B.加入催化剂,CO的产率增大 |
| C.增加碳的量,H2O(g)的转化率增大 | D.降低温度,H2O(g)的转化率降低 |
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式= 。
(2)该反应为 反应(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
a.容器中压强不变 b.混合气体中 c(CO)不变
c.υ正(H2)=υ逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为
℃。
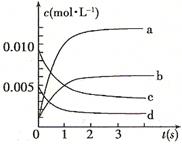
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)  2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K= 。
已知:
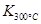 >
> ,则该反应是 热反应。
,则该反应是 热反应。(2)图中表示NO2的变化的曲线是 。用O2表示从0~2 s内该反应的平均速率v= 。
(3)能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动是 。
a.及时分离除NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
已知A(g)+B(g)  C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/℃ | 700 | 900 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1) 830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)="0.003" mol·L-1·s-1,则6s时c(A)=________mol·L-1, C的物质的量为______ mol;此时,正反应速率_____________(填“大于”、“小于”或“等于”)逆反应速率。
(2)在恒容密闭容器中判断该反应是否达到平衡的依据为________(填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c. c(A)不随时间改变 d.单位时间里生成c和D的物质的量相等
(3)1200℃时反应C(g)+D(g)
 A(g)+B(g)的平衡常数的值为___________________。
A(g)+B(g)的平衡常数的值为___________________。(4)绝热容器不与外界交换能量,在恒容绝热条件下,进行2M(g)+N(g)
 2P(g)+Q(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高,简述该反应的平衡常数与温度的变化关系:__________________________________________________________________________________。
2P(g)+Q(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高,简述该反应的平衡常数与温度的变化关系:__________________________________________________________________________________。| 物 质 | M | N | P | Q |
| 起始投料/mol | 2 | 1 | 2 | 0 |
 C(g)
C(g) 
 CH3CH2OH(g)+3H2O(g) -Q(Q>0)
CH3CH2OH(g)+3H2O(g) -Q(Q>0)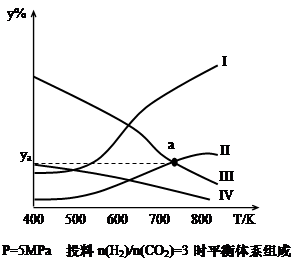
 xC(g) ΔH 有:
xC(g) ΔH 有: