题目内容
【题目】在75℃左右,用HgS04做催化剂,乙炔可水化为乙醛,但HgS04遇到某些特定物质常会发生催化剂中毒而失去催化作用,H2S就是其中一种。现用乙炔水化法,只用块状电石、浓硫酸、水、NaOH溶液、Hg0粉末五种物质制乙醛,装置如下图所示,请回答下列问题:

(1)实验开始时,仪器A中盛放电石,B中应装__________,其作用是__________。
(2)仪器D中盛放水,其作用是__________。
(3)蒸馏烧瓶F中应加入Hg0和另外两种试剂,若将三者分别直接加入,请按加入的先后顺序写出包括Hg0在内的各试剂的名称____________________。
(4)装置图中,加热F的方法叫__________,所选用温度计G的量程表示正确的是________(填字母)。
A.0℃~50℃ B.0℃~100℃ C.0℃~200℃ D.50℃~100℃ E.0℃~360℃
(5)检验乙醛已制出的操作及现象是__________。
【答案】 NaOH溶液 除去由A装置导出的气流中混有的H2S 吸收乙醛蒸气 氧化汞→水→浓硫酸 水浴加热 B 取D中少量溶液,加入新制氢氧化铜悬浊液加热若产生红色沉淀即可证明乙醛已生成
【解析】从题给条件来看:反应中需HgSO4,从反应装置来看,A为乙炔发生器,B为洗气瓶,F为主反应器;D为吸收器,结合问题和相关物质的性质解答。
(1)H2S具有酸性,能与碱液反应,如不除去,会导致催化剂中毒,因此B中应装NaOH溶液,目的是除去混合气体中H2S等气体,避免催化剂中毒;
(2)本实验目的是制备乙醛,乙醛易溶于水,可用蒸馏水收集,因此D中盛放水的作用是吸收生成的乙醛蒸气;
(3)加入药品时应先加固体药品,浓硫酸和水加入时要注意防止液体飞溅,应将密度大的加入到密度小的液体中,加入固体药品时要用纸槽或药匙,防止固体药品打破仪器,因此按加入的先后顺序为:氧化汞→水→浓H2SO4;
(4)根据装置图可判断加热F的方法叫水浴加热;由于温度控制在75℃左右,可以选择量程为0~100℃的温度计较适宜,答案选B;
(5)乙醛的检验,一般是利用了醛类物质的通性,即跟新制的Cu(OH)2反应生成砖红色沉淀,因此检验乙醛已制出的操作及现象是:取D中少量溶液,加入新制氢氧化铜悬浊液加热若产生红色沉淀即可证明乙醛已生成。

【题目】工业废水中常含有一定量氧化性较强的Cr2O72-,利用滴定原理测定Cr2O72-含量方法如下:
步骤Ⅰ:量取30.00 mL废水于锥形瓶中,加入适量稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液充分反应:Cr2O72-+6I-+14H+ === 2Cr3++3I2+7H2O。
步骤Ⅲ:向锥形瓶中滴入几滴指示剂。用滴定管量取0.1000 molL-1Na2S2O3溶液进行滴定,数据记录如下:(I2+2Na2S2O3 === 2NaI+Na2S4O6)
滴定次数 | Na2S2O3溶液起始读数/mL | Na2S2O3溶液终点读数/mL |
笫一次 | 1.02 | 19.03 |
第二次 | 2.00 | 19.99 |
第三次 | 0. 20 | a |
(1)步骤Ⅰ量取30.00 mL废水选择的仪器是_____。
(2)步骤Ⅲ中滴加的指示剂为_____。滴定达到终点的实验现象是____。
(3)步骤Ⅲ中a 的读数如图所示,则:
① a=_____。
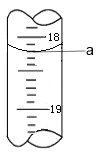
② Cr2O72-的含量为____gL-1。
(4)以下操作会造成废水中Cr2O72-含量测定值偏高的是_____。
A. 滴定终点读数时,俯视滴定管的刻度
B. 盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
C. 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D. 量取Na2S2O3溶液的滴定管用蒸馏水洗后未用标准液润洗
【题目】下列各组物质中,X既能与Y反应又能与Z反应的是
Y | X | Z | |
① | H2O(g) | Fe | ZnSO4溶液 |
② | KOH溶液 | Al | 稀硫酸 |
③ | Si | Cl2 | H2 |
④ | 酸性高锰酸钾溶液 | Fe2+(aq) | 漂白液 |
A.①③B.①④C.②③④D.②③
【题目】已知草酸晶体(H2C2O4·2H2O)的熔点为 101℃,170℃分解。下列选用的装置和药品能达到实验目的的是( )
A | B | C | D |
|
|
|
|
制取SO2 | 制取NO2 | H2C2O4·2H2O分解 | 分离苯与溴苯 |
A. AB. BC. CD. D





