题目内容
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)①形成的阴离子的结构示意图为___。如果③原子中含8个中子,则其原子符号为___。
(2)③、④、⑤、⑥简单离子半径由小到大的顺序为___。(填离子符号)
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:___。
(4)设计实验证明⑧的非金属性比⑦强,用化学方程式表示___。
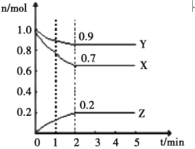
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
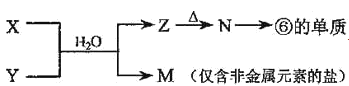
(a)X溶液与Y溶液反应的离子方程式为___。
(b)N→⑥的单质的化学方程式为___。
【答案】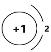
![]() N Al3+<Na+<O2-<N3-
N Al3+<Na+<O2-<N3- ![]() 或
或![]() 2HClO4+Na2SiO3=2NaClO4+H2SiO3↓(或H2O+2HClO4+Na2SiO3=2NaClO4+H4SiO4↓) Al3++3NH3·H2O=Al(OH)3↓+3NH
2HClO4+Na2SiO3=2NaClO4+H2SiO3↓(或H2O+2HClO4+Na2SiO3=2NaClO4+H4SiO4↓) Al3++3NH3·H2O=Al(OH)3↓+3NH![]() 2Al2O3
2Al2O3![]() 4Al+3O2↑
4Al+3O2↑
【解析】
根据元素①~⑧在表中的位置,可确定①~⑧的元素符号分别为H、C、N、O、Na、Al、Si、Cl。
(1)①形成的阴离子为H-,原子核外含有2个电子,则离子结构示意图为![]() 。③为N,若原子中含8个中子,则质量数为15,其原子符号为
。③为N,若原子中含8个中子,则质量数为15,其原子符号为![]() N。
N。
(2)③、④、⑤、⑥简单离子分别为N3-、O2-、Na+、Al3+,均含有相同的核外电子排布,原子序数越大离子半径越小,则离子半径由小到大的顺序为Al3+<Na+<O2-<N3-。
(3)①、④、⑤、⑧分别为H、O、Na、Cl,其中的某些元素可形成既含离子键又含极性共价键的化合物,如NaClO、NaOH、NaClO2、NaClO3等,写出其中一种化合物的电子式:![]() 或
或![]() 。
。
(4)根据非金属的非金属性越强,其最高价氧化物对应水化物的酸性越强,或非金属元素的物质与氢气反应的难易程度判断,实验证明Cl的非金属性比Si强,用化学方程式表示为2HClO4+Na2SiO3=2NaClO4+H2SiO3↓。
(5)已知⑥为Al,则N为氧化铝,Z为氢氧化铝;M为仅含有非金属元素的盐,则M中含有铵根离子,则X、Y中一定有一种为氨水溶液,另一溶液则为氯化铝溶液。
(a)X溶液与Y溶液的反应为铝离子与一水合氨反应生成氢氧化铝沉淀和铵根离子的反应,离子方程式Al3++3NH3·H2O=Al(OH)3↓+3NH4+;
(b)氧化铝→Al单质的化学方程式为2Al2O3![]() 4Al+3O2↑。
4Al+3O2↑。