题目内容
【题目】Ⅰ.已知X元素和碳元素同主族,位于周期表中的第1个长周期,是最早使用的半导体材料。短周期元素Y原子的最外层电子数比内层电子总数少3,它们形成的化合物的分子式是XY4。
(1)元素Y原子核外电子有___________种不同运动状态。
(2)X元素原子的价电子的轨道表示式为______________________________.
(3)若X、Y两元素电负性分别为2.1和3.0,则XY4中X与Y之间的化学键为________(填“共价键”或“离子键”)。
(4)该化合物分子为________(填“极性”或“非极性”)分子。
Ⅱ. 已知X、Y为第3周期的两种元素,其原子的部分电离能(kJ·mol-1)如下表所示:
I1 | I2 | I3 | I4 | |
X | 496 | 4562 | 6912 | 9540 |
Y | 577 | 1817 | 2754 | 11578 |
(5)Y单质与X的最高价氧化物对应的水化物反应的化学方程式为:_________。
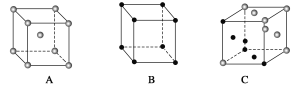
(6)X晶体采用的堆积方式与金属钾相同,X晶体采用下列________(填字母)堆积方式。
(7)NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
晶体 | NaCl | KCl | CaO |
晶格能/kJ·mol-1 | 786 | 715 | 3401 |
四种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是____________________。
【答案】17 ![]() 共价键 非极性 2Al+2NaOH+6H2O=2Na [Al(OH)4]+3 H2↑(或2Al + 2NaOH +2H2O=2NaAlO2 + 3H2↑) A MgO>CaO>NaCl>KCl
共价键 非极性 2Al+2NaOH+6H2O=2Na [Al(OH)4]+3 H2↑(或2Al + 2NaOH +2H2O=2NaAlO2 + 3H2↑) A MgO>CaO>NaCl>KCl
【解析】
Ⅰ.X元素与碳元素同主族且位于周期表中的第一长周期,X为Ge元素,Y原子是短周期元素且最外层电子数比内层电子总数少3,Y为Cl元素,化合物XY4为GeCl4,据此分析解答(1)-(4);
Ⅱ. X、Y为第3周期的两种元素,根据电离能的数值可知,X最外层只有1个电子,为Na元素;Y最外层有3个电子,为Al元素,据此分析解答(5)-(7)。
Ⅰ.根据上述分析,X为Ge元素,Y为Cl元素,化合物XY4为GeCl4。
(1)Y为Cl元素, Cl元素是17号元素,核外电子有17种不同运动状态,故答案为:17;
(2)X为Ge元素,位于第四周期第ⅣA族,Ge元素是32号元素,基态原子核外电子排布式为ls22s22p63s23p63d104s24p2,价电子的轨道表示式为![]() ,故答案为:
,故答案为: ![]() ;
;
(3)若X、Y两元素电负性分别为2.1和3.0,则XY4中X与Y的电负性的差值为0.9<1.7,X与Y之间形成共价键,故答案为:共价键;
(4) GeCl4中Ge的价层电子对数=4+0=4,采用sp3杂化,为正四面体结构,分子中正负电荷的重心重合,属于非极性分子,故答案为:非极性;
Ⅱ. 根据上述分析,X为Na元素;Y为Al元素。
(5)铝单质与钠的最高价氧化物对应的水化物氢氧化钠反应的化学方程式为2Al+2NaOH+6H2O=2Na [Al(OH)4]+3 H2↑(或2Al + 2NaOH +2H2O=2NaAlO2 + 3H2↑),故答案为:2Al+2NaOH+6H2O=2Na [Al(OH)4]+3H2↑(或2Al + 2NaOH +2H2O=2NaAlO2 + 3H2↑);
(6)钠属于体心立方堆积,故答案为:A;
(7)离子半径Mg2+<Na+<O2-<Ca2+<Cl-;离子所带电荷数Na+=Cl-<O2-=Mg2+=Ca2+,离子晶体的离子半径越小,所带电荷数越多,晶格能越大,则离子晶体的熔沸点越高,则有NaCl、KCl、MgO、CaO熔点由高到低的顺序是MgO>CaO>NaCl>KCl,故答案为:MgO>CaO>NaCl>KCl。