题目内容
18.利用海洋资源可以获得很多物质,如从海水得到的食盐水可以用来制取食盐,可以用来电解得到许多化工原料,可以通过蒸馏获得淡水,等等.(一)从海水得到的粗食盐水常含Ca2+、Mg2+、SO42-,需要分离提纯.现有含少量CaCl2、MgSO4的粗食盐水,在除去悬浮物和泥沙之后,要用4种试剂①盐酸、②Na2CO3、③NaOH、④BaCl2来除去食盐水中的Ca2+、Mg2+、SO42-.
(1)除去Ca2+、Mg2+过程中发生反应的离子方程式为Mg2++2OH-=Mg(OH)2,Ca2++CO32-=CaCO3↓.
(2)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为BC
A.先加NaOH,后加Na2CO3,再加BaCl2
B.先加NaOH,后加BaCl2,再加Na2CO3
C.先加BaCl2,后加NaOH,再加Na2CO3
(3)判断试剂NaOH已经足量的方法是静置,取上层清液于试管中,继续滴加NaOH溶液,如果不再产生沉淀,则说明NaOH溶液已经足量;
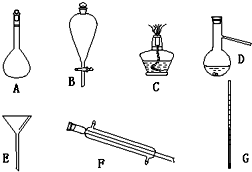
(4)现有如图仪器,过滤出沉淀时必须用到E(填字母),仪器F的名称是冷凝管.
(二)海水蒸馏是由海水获得淡水的常用方法之一,在实验室组成一套蒸馏装置肯定需要上述仪器中的一部分,按照实验仪器由下向上,从左到右的顺序,这些仪器依次是CDGF(填字母).
(三)海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要上述仪器中的
B(填字母),该仪器名称为分液漏斗,向该碘水中加入四氯化碳以提取碘单质的实验操作称为萃取.
分析 (一)(1)除去Mg2+与NaOH反应,除去Ca2+与Na2CO3反应;
(2)先加入过量的氢氧化钠可以除去镁离子,加入氯化钡可以除去硫酸根离子,加入适量的碳酸钠可以除去钙离子和反应剩余的氯化钡,(注意碳酸钠必须加在氯化钡的后面)最后加入适量的盐酸可以除去反应剩余的氢氧化钠和碳酸钠;
(3)当NaOH溶液过量时,继续滴加NaOH溶液,无沉淀产生;
(4)过滤操作必须用到漏斗、烧杯、玻璃棒等,根据仪器的形状来确定其名称;
(二)蒸馏装置需要的仪器为酒精灯、蒸馏烧瓶、冷凝管等;
(三)从碘水中提取碘,需进行萃取分液操作,必须使用的仪器是分液漏斗.
解答 解:(一)(1)除去Mg2+与NaOH反应,除去Ca2+与Na2CO3反应,发生的离子反应分别为Mg2++2OH-=Mg(OH)2↓、Ca2++CO32-=CaCO3↓,
故答案为:Mg2++2OH-=Mg(OH)2↓;Ca2++CO32-=CaCO3↓;
(2)有效除去Ca2+、Mg2+、SO42-,应选择试剂顺序为③NaOH、④BaCl2、②Na2CO3或③④BaCl2、NaOH、②Na2CO3(注意碳酸钠必须加在氯化钡的后面),最后加入适量的盐酸可以除去反应剩余的氢氧化钠和碳酸钠,故答案为:BC;
(3)当NaOH溶液过量时,取上层清液于试管中,继续滴加NaOH溶液,无沉淀产生,则说明氢氧化钠溶液已过量,故答案为:静置,取上层清液于试管中,继续滴加NaOH溶液,如果不再产生沉淀,则说明NaOH溶液已经足量;
(4)过滤操作必须用到漏斗、烧杯、玻璃棒等,即上述仪器必须使用E;F仪器的名称为冷凝管,故答案为:E;冷凝管;
(二)蒸馏装置需要的仪器为酒精灯、蒸馏烧瓶、温度计、冷凝管等,按照实验仪器由下向上,从左到右的顺序,这些仪器依次是CDGF,故答案为:CDGF;
(三)从碘水中提取碘,需进行萃取分液操作,需要上述仪器中的是B分液漏斗,向该碘水中加入四氯化碳以提取碘单质的实验操作为萃取,故答案为:B;分液漏斗;萃取.
点评 本题考查海水资源及其综合利用,涉及粗盐提纯、混合物分离、提纯的基本方法选择与应用,为高频考点,把握物质的性质及常见混合物分离提纯方法为解答的关键,注意粗盐提纯中试剂的加入顺序及试剂过量为解答的难点,题目难度不大.

 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案| A. | 3 mol/L HCl | B. | 4 mol/L HNO3 | C. | 8 mol/L NaOH | D. | 18 mol/L H2SO4 |
 向盐酸和AlCl3的混合溶液中逐滴加入NaOH溶液至过量,生成沉淀Al(OH)3的量随着加入NaOH溶液体积的变化关系如图所示,下列说法正确的是
向盐酸和AlCl3的混合溶液中逐滴加入NaOH溶液至过量,生成沉淀Al(OH)3的量随着加入NaOH溶液体积的变化关系如图所示,下列说法正确的是( )
| A. | 在a点对应的溶液中,加入Mg2+、I-、NH4+、NO3-离子仍能大量共存 | |
| B. | 图中B→C的过程中,实际发生的离子方程式为Al(OH)3+OH-=AlO2-+2H2O | |
| C. | 若b、c的纵坐标数值相同,则横坐标数值之比为1:3 | |
| D. | 原溶液中盐酸和AlCl3物质的量的浓度之比为1:3 |
| A. | 其他条件不变时,增大反应的物质的量,反应速率增大,化学平衡发生移动 | |
| B. | 其他条件不变时,升高温度,化学平衡向放热反应的方向移动 | |
| C. | 其他条件不变时,增大压强,化学反应速率增大,化学平衡发生移动 | |
| D. | 其他条件不变时,使用催化剂,化学反应速率改变,化学平衡不移动 |
| 混合物 | 试剂 | 分离方法 | |
| ① | 苯(苯酚) | 氢氧化钠溶液 | 分液 |
| ② | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| ③ | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 蒸馏 |
| ④ | 乙炔(硫化氢) | 硫酸铜 | 洗气 |
| A. | ②③④ | B. | ②③ | C. | ③④ | D. | ③ |