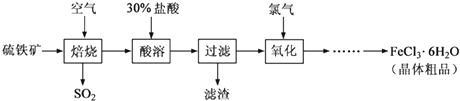
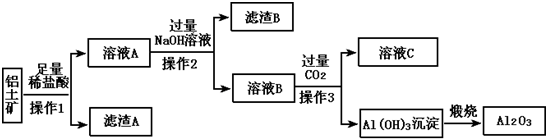
题目内容
8.将等物质的量的镁和铝相混合,取四份等质量的该混合物分别加到足量的下列溶液中,充分反应后,放出氢气最多的是( )| A. | 3 mol/L HCl | B. | 4 mol/L HNO3 | C. | 8 mol/L NaOH | D. | 18 mol/L H2SO4 |
分析 Mg、Al都和稀盐酸反应生成氢气,与足量浓硫酸、硝酸发生氧化还原反应不生成氢气,只有Al和NaOH反应生成氢气,据此分析解答.
解答 解:Mg、Al与浓硫酸、硝酸发生氧化还原反应不生成氢气,因Mg、Al均与盐酸反应生成氢气,Mg不与氢氧化钠反应,只有Al与NaOH反应生成氢气,故等物质的量的镁和铝相混合反应时,与盐酸生成氢气最多,故选A.
点评 本题考查元素化合物知识,侧重考查硝酸、浓硫酸及铝的性质,难度不大,明确发生的反应即可解答.

练习册系列答案
相关题目
13.NPG的结构式如图,有关NPG说法错误的是( )


| A. | NPG与乙二醇互为同系物 | |
| B. | 1mol该醇与足量的钠反应放出1mol H2 | |
| C. | NPG一定条件下能发生取代反应、酯化反应、氧化反应、加成反应、加聚反应 | |
| D. | 分子式为C5H12O2 |
19.下列原子构成的单质中既能与稀硫酸反应又能与烧碱溶液反应,都产生H2的是( )
| A. | 核内无中子的原子 | |
| B. | 价电子构型为3s23p1 | |
| C. | 最外层电子数等于倒数第三层上的电子数的原子 | |
| D. | N层上无电子,最外层上的电子数等于电子层数的原子 |
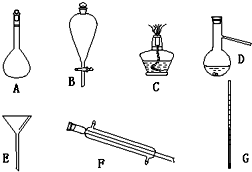
20.用下列实验装置进行相应实验,能达到实验目的是( )
| 选项 | A | B | C | D |
| 装置 | 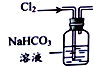 | 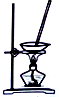 | 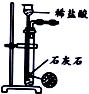 | 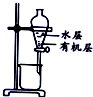 |
| 目的 | 除去Cl2中含有的少量HCl | 蒸发NaCl饱和溶液制备NaCl晶体 | 制取少量纯净的CO2气体 | 分离酒精和水的混合溶液 |
| A. | A | B. | B | C. | C | D. | D |
17.下列离子方程式错误的是( )
| A. | Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | 将少量铜屑放入浓硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| C. | 过量的二氧化碳通入“水玻璃”中:CO2+SiO32-+H2O═CO32-+H2SiO3↓ | |
| D. | Cl2通入NaOH稀溶液中:Cl2+2OH-═Cl-+ClO-+H2O |
 .
.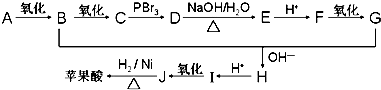
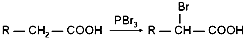
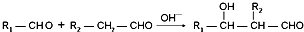
 +n HO-CH2CH2-OH$\stackrel{一定条件}{→}$
+n HO-CH2CH2-OH$\stackrel{一定条件}{→}$ +(2n-1)H2O
+(2n-1)H2O 、
、 .
.