题目内容
碱性电池具有容量大、放电电流大的特点,因而得到广泛使用,锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应为Zn+2MnO2+H2O═Zn(OH)2+Mn2O3,下列说法错误的是( )
| A、电池工作时,锌失去电子 |
| B、电池正极反应式为:2MnO2+H2O+2e-═Mn2O3+2OH- |
| C、电池工作时,负极附近pH降低 |
| D、正极是水电离出的H+得到电子 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:根据电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),可知反应中Zn被氧化,为原电池的负极,负极反应为Zn-2e-+2OH-═Zn(OH)2,MnO2为原电池的正极,发生还原反应,正极反应为2MnO2(s)+H2O(1)+2e-═Mn2O3(s)+2OH-(aq),以此解答该题.
解答:
解;A.该电解质溶液呈碱性,放电时,负极上锌失电子发生氧化反应,电极反应式为Zn(s)+2OH-(aq)-2e-=Zn(OH)2(s),故A正确;
B.正极上二氧化锰得电子发生还原反应,电极反应式为2MnO2+H2O+2e-═Mn2O3+2OH-,故B正确;
C.放电时,负极上氢氧根离子参加反应导致负极附近氢氧根离子浓度减小,则pH降低,故C正确;
D.正极发生2MnO2+H2O+2e-═Mn2O3+2OH-,故D错误.
故选D.
B.正极上二氧化锰得电子发生还原反应,电极反应式为2MnO2+H2O+2e-═Mn2O3+2OH-,故B正确;
C.放电时,负极上氢氧根离子参加反应导致负极附近氢氧根离子浓度减小,则pH降低,故C正确;
D.正极发生2MnO2+H2O+2e-═Mn2O3+2OH-,故D错误.
故选D.
点评:本题考查了化学电源新型电池,明确原电池原理是解本题关键,难点的电极反应式的书写,要结合电解质溶液的酸碱性书写,难度中等.

练习册系列答案
 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
下列装置中四块相同的Zn片,放置一段时间后腐蚀速率由慢到快的顺序是( )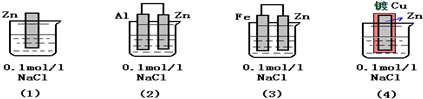

| A、(1)(3)(2)(4) |
| B、(4)(2)(1)(3) |
| C、(3)(2)(1)(4) |
| D、(4)(1)(2)(3) |
下列叙述中正确的是( )
| A、最外层有2个电子的原子都是金属原子 |
| B、除短周期外,其他周期均有18个元素 |
| C、副族元素中没有非金属元素 |
| D、碱金属元素是指IA族的所有元素 |
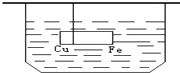 在装有水的容器中,用棉线悬挂一个在水中保持平衡的金属棒,该棒由铁和铜焊接而成,棉线系在两种金属接缝处(如图),再向水中加入少量CuSO4,经过一段时间应看到的现象是( )
在装有水的容器中,用棉线悬挂一个在水中保持平衡的金属棒,该棒由铁和铜焊接而成,棉线系在两种金属接缝处(如图),再向水中加入少量CuSO4,经过一段时间应看到的现象是( )| A、铁端将附着铜增重下沉 |
| B、铜端将附着铜增重下沉 |
| C、铁端将变细减重上升 |
| D、铜端粗细不变将下沉 |
下列粒子能促进水的电离,且使溶液呈酸性是( )
| A、CO32- |
| B、Fe3+ |
| C、HSO4- |
| D、Cl- |
类推是一种重要的学习方法,但如果不具体问题具体分析就会得出错误结论.下列类推结论正确的是( )
| A、SiH4的熔沸点比CH4高,则PH3的熔沸点比NH3高 |
| B、钠在空气中燃烧生成过氧化钠,则锂在空气中燃烧生成过氧化锂 |
| C、Al(OH)3能溶于NaOH溶液,则Be(OH)2能溶于NaOH溶液 |
| D、甲酸甲酯能发生银镜反应,则乙酸甲酯能发生银镜反应 |
以下实验操作错误的是( )
| A、应将浓硝酸存放在棕色玻璃瓶中 |
| B、用托盘天平称量固体的质量时,砝码放在右盘 |
| C、在盛有液溴的试剂瓶里加些水,以防溴挥发 |
| D、少量金属钠保存在水中 |
下列物质中,既能与盐酸反应,又能与氢氧化钠溶液反应的是( )
| A、Mg(OH)2 |
| B、Al(OH)3 |
| C、SiO2 |
| D、SO2 |