题目内容
16.下列推断中,符合实际的是( )| A. | 第n周期的最后一种金属元素位于第n主族(n>1) | |
| B. | 第n周期有(8-n)种非金属元素(n>1) | |
| C. | 若元素原子最外层电子数为m,电子层为n,则m-n=5的主族元素最高价含氧酸为最强酸 | |
| D. | 短周期元素中最外层电子数为2的元素一定是第ⅡA族元素 |
分析 A.根据金属和非金属的分界线可判断元素在周期表中的分布;
B.根据第二周期有6种非金属元素,第三周期有5种非金属性元素,第四周期有4种非金属元素,第五周期有3种非金属元素,第六周期有2种非金属元素,第七周期应有1种非金属元素,可得出规律;
C.如为F,则不存在含氧酸;
D.短周期元素中最外层电子数为2的元素可能为He.
解答 解:A.第n周期第n主族的元素的核外电子层数和最外层电子数相等,可能为Be、Al、Ge、Sb、Po等,为金属元素,故A正确;
B.根据第二周期有6种非金属元素,第三周期有5种非金属性元素,第四周期有4种非金属元素,第五周期有3种非金属元素,第六周期有2种非金属元素,第七周期应有1种非金属元素,由此可得出第n周期有(8-n)种非金属元素(1<n≤7,包括稀有气体),故B正确;
C.如为F,位于周期表第二周期,第ⅦA族,不存在含氧酸,故C错误;
D.短周期元素中最外层电子数为2的元素可能为He,为零族元素,故D错误.
故选AB.
点评 本题考查元素周期表的结构和应用,题目难度不大,本题注意把握元素周期表的结构特点,学习中善于把握相关组成规律,在解答题目时会起到事半功倍的作用.

练习册系列答案
相关题目
6.一定条件下存在反应:CO(g)+H2O(g)?CO2(g)+H2(g),△H<0.现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器I、II、III:
在I中充入1mol CO和1mol H2O,在II中充入1mol CO2 和1mol H2,
在III中充入2mol CO 和2mol H2O,
700℃条件下开始反应,达到平衡时,下列说法正确的是( )
在I中充入1mol CO和1mol H2O,在II中充入1mol CO2 和1mol H2,
在III中充入2mol CO 和2mol H2O,
700℃条件下开始反应,达到平衡时,下列说法正确的是( )
| A. | 容器I、II中正反应速率相同 | |
| B. | 容器I、III中反应的平衡常数相同 | |
| C. | 容器I中CO 的物质的量比容器II中的少 | |
| D. | 容器I中CO 的转化率与容器II中CO2 的转化率之和小于1 |
7.下列叙述中正确的是( )
| A. | 氧化剂中的每一种元素在反应中都得到电子 | |
| B. | 还原剂在同一反应中既可以是反应物,也可以是生成物 | |
| C. | 失电子多的还原剂,还原性不一定强 | |
| D. | 阳离子只有氧化性,阴离子只有还原性 |
1.下列离子反应方程书写正确的是( )
| A. | H2O+H2O═H3O++OH- | |
| B. | CO32-+2H2O?H2CO3+2OH- | |
| C. | Ca(OH)2+2H+?Ca2++2H2O | |
| D. | 2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑ |
8.下列说法不正确的是( )
| A. | (CH3)2C=CHCH2CH3的名称为2-甲基-2-戊烯 | |
| B. | 乙醇、乙二醇、丙三醇的沸点依次升高 | |
| C. | 1mol乙酰水杨酸( 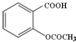 )最多可以和2mol NaOH反应 )最多可以和2mol NaOH反应 | |
| D. | 可用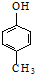 和HCHO 为原料合成 和HCHO 为原料合成 |
5.现有0.1mol•L-1的醋酸溶液,下列说法正确的是( )
| A. | 加水稀释,溶液中所有离子的浓度都减小 | |
| B. | 溶液中n(CH3COO-)+n(CH3COOH)=0.1mol | |
| C. | 升高温度,醋酸的电离度增大 | |
| D. | 中和1L等物质的量浓度的NaOH溶液所消耗的醋酸体积大于1L |