题目内容
8.下列说法不正确的是( )| A. | (CH3)2C=CHCH2CH3的名称为2-甲基-2-戊烯 | |
| B. | 乙醇、乙二醇、丙三醇的沸点依次升高 | |
| C. | 1mol乙酰水杨酸( 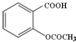 )最多可以和2mol NaOH反应 )最多可以和2mol NaOH反应 | |
| D. | 可用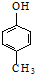 和HCHO 为原料合成 和HCHO 为原料合成 |
分析 A.烯烃的命名选取含有碳碳双键的最长碳链,距离碳碳双键最近的一端为1号碳;
B.乙醇、乙二醇、丙三醇相对分子质量逐渐增大,氢键数目增多;
C.1mol乙酰水杨酸消耗3molNaOH;
D.苯酚与甲醛能合成酚醛树脂.
解答 解:A.(CH3)2C=CHCH2CH3的名称为2-甲基-2-戊烯,故A正确;
B.乙醇、乙二醇、丙三醇相对分子质量逐渐增大,氢键数目增多,则乙醇、乙二醇、丙三醇的沸点依次升高,故B正确;
C.乙酰水杨酸水解生成酚羟基和羧基,则1mol乙酰水杨酸消耗3molNaOH,故C错误;
D.苯酚与甲醛能合成酚醛树脂,可用 和HCHO为原料合成
和HCHO为原料合成 ,故D正确,
,故D正确,
故选C.
点评 本题考查有机物的结构和性质,为高频考点和常见题型,侧重于学生的分析的考查,注意把握有机物的官能团的性质以及有机物的结构,难度不大.

练习册系列答案
相关题目
18.常温下某溶液中由水电离出的c(H+)与c(OH-)的乘积为10-20,该溶液可能是( )
| A. | pH等于4的NH4Cl溶液 | B. | pH等于4的H2SO4溶液 | ||
| C. | pH等于10的Na2CO3溶液 | D. | 一定浓度的NaCl溶液 |
16.下列推断中,符合实际的是( )
| A. | 第n周期的最后一种金属元素位于第n主族(n>1) | |
| B. | 第n周期有(8-n)种非金属元素(n>1) | |
| C. | 若元素原子最外层电子数为m,电子层为n,则m-n=5的主族元素最高价含氧酸为最强酸 | |
| D. | 短周期元素中最外层电子数为2的元素一定是第ⅡA族元素 |
3. 已知某可逆反应mA(g)+nB(g)?pC(g)+Q在密闭容器中进行反应,测得在不同时间t、温度T和压强P与反应物B在混合气中的百分含量B%的关系曲线如图所示.则( )
已知某可逆反应mA(g)+nB(g)?pC(g)+Q在密闭容器中进行反应,测得在不同时间t、温度T和压强P与反应物B在混合气中的百分含量B%的关系曲线如图所示.则( )
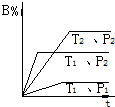 已知某可逆反应mA(g)+nB(g)?pC(g)+Q在密闭容器中进行反应,测得在不同时间t、温度T和压强P与反应物B在混合气中的百分含量B%的关系曲线如图所示.则( )
已知某可逆反应mA(g)+nB(g)?pC(g)+Q在密闭容器中进行反应,测得在不同时间t、温度T和压强P与反应物B在混合气中的百分含量B%的关系曲线如图所示.则( )| A. | T1<T2,P1>P2,m+n>P,△H>0 | B. | T1>T2,P2>P1,m+n<P,△H>0 | ||
| C. | T2>T1,P2>P1,m+n<P,△H>0 | D. | T1>T2,P2>P1,m+n>P,△H<0 |
13.NA为阿伏加德罗常数的值,下列正确的是( )
| A. | 1molAl3+含有的核外电子数为3NA | |
| B. | 0.1L3mol/L的硝酸铵溶液中含有的NH4+数目为0.3NA | |
| C. | 标准状况下22.4L盐酸中一定含有0个HCl分子 | |
| D. | 100mlPH=1的醋酸溶液中含有的H+可能小于0.01NA |
20.下列说法正确的是( )
| A. | 用K37ClO3与浓盐酸制氯气:37ClO3-+6H++6Cl-═37Cl-+3Cl2↑+3H2O | |
| B. | 在溶液中等物质的量的FeBr2与Cl2反应:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | 将1mol/L的NaAlO2溶液和2.5mol/L的HCl溶液等体积均匀混合 AlO2-+H++H2O═Al(OH)3↓ | |
| D. | 0.1mol/L的Na2CO3溶液中2 C(Na+)═C (HCO3-)+C (H2CO3)+C(CO32-) |
17.W、X、Y、Z均为短周期元素,W、X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构,W和Z的最外层电子数相同.下列说法正确的是( )
| A. | W、X的最高价氧化物对应水化物的酸性:X>W | |
| B. | 单质沸点:Y>Z>W | |
| C. | 离子半径:X->W->Y+>Z- | |
| D. | 结合质子能力:X2->W- |