题目内容
【题目】下列说法中正确的是( )
A. 1molOH﹣的质量为17gmol﹣1
B. 0.5mol H2所占体积约为11.2L
C. 等质量的金刚石和晶体硅所含原子个数之比为7:3
D. 1mol NaCl固体溶于0.5L水中,所得溶液的物质的量浓度为2molL﹣1
【答案】C
【解析】
A.1mol氢氧根离子的质量为:17g/mol×1mol=17g,选项A错误;B.不是标准状况下,不能使用标准状况下的气体摩尔体积计算,选项B错误;C.根据n=![]() 可知,质量相等时,二者物质的量之比与摩尔质量成反比,则金刚石中C原子与硅原子的物质的量之比与摩尔质量成反比,二者物质的量之比=28g/mol:12g/mol=7:3,则二者含有原子的数目之比=原子的物质的量之比=7:3,选项C正确;D.1mol NaCl固体溶于0.5L水中,所得溶液的体积不是0.5L,无法计算溶液浓度,选项D错误;答案选C。
可知,质量相等时,二者物质的量之比与摩尔质量成反比,则金刚石中C原子与硅原子的物质的量之比与摩尔质量成反比,二者物质的量之比=28g/mol:12g/mol=7:3,则二者含有原子的数目之比=原子的物质的量之比=7:3,选项C正确;D.1mol NaCl固体溶于0.5L水中,所得溶液的体积不是0.5L,无法计算溶液浓度,选项D错误;答案选C。

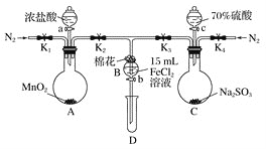
【题目】下图是实验室用乙醇与浓硫酸和溴化钠反应来制备溴乙烷的装置,反应需要加热,图中省去了加热装置。有关数据见下表。
乙醇 | 溴乙烷 | 溴 | |
状态 | 无色液体 | 无色液体 | 深红棕色液体 |
密度/g.cm-3 | 0.79 | 1.44 | 3.1 |
沸点/℃ | 78.5 | 38.4 | 59 |
(1)制备操作中,加入的浓硫酸必须进行稀释,其目的是_____(填字母)。
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(2)己知加热温度较低时NaBr与硫酸反应生成NaHSO4,写出加热时A中发生的主要反应的化学方程式:________________。
(3)仪器B的名称是________,冷却水应从B的____(填“上“或“下")口流进。
(4)反应生成的溴乙烷应在______(填“A"或"C")中。
(5)若用浓的硫酸进行实验时,得到的溴乙烷呈棕黄色,最好选择下列_____(填字母)溶液来洗涤产品。
a氢氧化钠 b.碘化亚铁 c.亚硫酸钠 d.碳酸氢钠
洗涤产品时所需要的玻璃仪器有_______________。
【题目】某温度下,在甲、乙、丙、丁四个恒容密闭容器中投入H2和I2,发生反应:H2(g)+I2(g)![]() 2HI(g)。反应体系中各物质浓度的有关数据如下。
2HI(g)。反应体系中各物质浓度的有关数据如下。
容器 | 起始浓度 | 平衡浓度 | |
c(H2)/mol·L-1 | c(I2)/mol·L-1 | c(HI)/mol·L-1 | |
甲 | 0.01 | 0.01 | 0.004 |
乙 | 0.01 | 0.02 | a |
丙 | 0.02 | 0.01 | b |
丁 | 0.02 | 0.02 | —— |
下列判断正确的是
A. H2的平衡浓度:a=b>0.004 B. 平衡时,H2的转化率:丁>甲
C. 平衡时,乙中H2的转化率等于20% D. 丙中条件下,该反应的平衡常数K=4