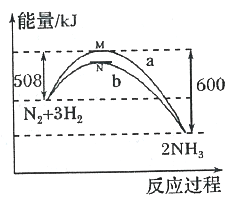
题目内容
【题目】化学是以实验为基础的学科。
(1)下列有关实验叙述正确的是________(填序号)。
a.试管、烧杯均可用于给液体、固体加热
b.使食盐水中NaCl结晶析出时,常用到的仪器有坩埚、酒精灯、玻璃棒、泥三角
c.用铁坩埚灼烧烧碱
d.分液时,下层液体先从分液漏斗下口放出,换一个接收容器,再将上层液体从分液漏斗下口放出
e.用托盘天平称取25.20g氯化钠
f.取用金属钠或钾时,没用完的钠或钾要放回原瓶
(2)实验室用密度为1.25g/mL,质量分数为36.5%的浓盐酸配制240mL 0.1mol/L的盐酸,应量取浓盐酸体积________mL。使用的仪器除玻璃棒、烧杯、量筒外,还需要_______。
【答案】cf 2.0 250mL的容量瓶、胶头滴管
【解析】
(1)依据实验基本操作步骤作答;
(2)先依据c=![]() 计算浓盐酸的物质的量浓度,实验室无240mL容量瓶,故应选择250mL容量瓶,配制出250mL的溶液,根据溶液稀释前后所含溶质的物质的量不变计算需要浓盐酸的体积;再结合配制过程选择所需仪器。
计算浓盐酸的物质的量浓度,实验室无240mL容量瓶,故应选择250mL容量瓶,配制出250mL的溶液,根据溶液稀释前后所含溶质的物质的量不变计算需要浓盐酸的体积;再结合配制过程选择所需仪器。
(1)a. 试管可用于给液体、固体加热,但烧杯只能用于液体加热,a项错误;、
b. 使食盐水中NaCl结晶析出的操作是蒸发浓缩、冷却结晶,所用到的仪器蒸发皿、酒精灯、玻璃棒、泥三角,而不是坩埚,b项错误;
c. 普通玻璃或陶瓷坩埚都含有二氧化硅,能与烧碱反应,而铁坩埚不会与烧碱反应,因此用铁坩埚灼烧烧碱,c项正确;
d. 分液时,为避免上下液体混合,则分液漏斗先从下口放出下层液体,再从上口倒出上层液体,d项错误;
e. 托盘天平的精确度为![]() 0.1g,不能称取25.20g氯化钠,e项错误;
0.1g,不能称取25.20g氯化钠,e项错误;
f. 取用金属钠或钾时,没用完的钠或钾要放回原瓶,需妥善保管,f项正确;
答案为cf;
(2)浓盐酸的物质的量浓度c=![]() =
=![]() =12.5mol/L,要配置240mL的溶液,应选择250mL的容量瓶,设需要浓盐酸的体积为V,依据溶液稀释前后所含溶质的物质的量不变得V×12.5mol/L = 250mL×0.1mol/L,解得V=2.0mL;根据配制一定物质的量浓度溶液的步骤为计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶可知,使用的仪器除玻璃棒、烧杯、量筒外,还需要250mL的容量瓶、胶头滴管。
=12.5mol/L,要配置240mL的溶液,应选择250mL的容量瓶,设需要浓盐酸的体积为V,依据溶液稀释前后所含溶质的物质的量不变得V×12.5mol/L = 250mL×0.1mol/L,解得V=2.0mL;根据配制一定物质的量浓度溶液的步骤为计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶可知,使用的仪器除玻璃棒、烧杯、量筒外,还需要250mL的容量瓶、胶头滴管。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案