题目内容
【题目】碳、硫、氮及其化合物在工农业、国防等领域占有重要地位。
(1)已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ/mol
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H2
若16gCH4和NO2充分反应,生成N2、CO2(g)和H2O(g),共放出热量867kJ,则△H2=___。
(2)工业生产中产生的SO2废气若用Na2SO3溶液吸收,得到浓度均为0.1mol·L-1的Na2SO3、NaHSO3混合溶液,则![]() =__。经测定,所得溶液呈酸性,则溶液中离子浓度由大到小的顺序为___。
=__。经测定,所得溶液呈酸性,则溶液中离子浓度由大到小的顺序为___。
(3)N2O4与NO2之间存在反应N2O4(g)2NO2(g)。在一定条件下,该反应N2O4、NO2的消耗速率与自身压强间存在关系v(N2O4)=k1p(N2O4),v(NO2)=k2p2(NO2),其中k1、k2是与反应温度有关的常数。相应的速率-分压强关系如图所示,一定温度下,k1、k2与平衡常数Kp(用平衡分压代替平衡浓度计算)的关系是k1=__,在图上标出的点中,能表示反应达到平衡状态的点为__(填字母代号)。

(4)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。
①NH3与NO2生成N2的反应中,当生成1molN2时,转移的电子为___mol。
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置见图1)。反应相同时间NOx的去除率随反应温度的变化曲线如图2所示,在50~250℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是___;当反应温度高于380℃时,NOx的去除率迅速下降的原因可能是___。

【答案】-1160kJ·mol-1 1.5 c(Na+)>c(SO32-)>c(HSO3-)>c(H+)>c(OH-) ![]() K2Kp B、D
K2Kp B、D ![]() 迅速上升段是催化剂活性随温度升高增大,与温度升高共同使NOx去除反应速率迅速增大;上升阶段缓慢主要是温度升高引起的NOx去除反应速率增大但是催化剂活性下降 氨气在该条件下与氧气反应生成NO
迅速上升段是催化剂活性随温度升高增大,与温度升高共同使NOx去除反应速率迅速增大;上升阶段缓慢主要是温度升高引起的NOx去除反应速率增大但是催化剂活性下降 氨气在该条件下与氧气反应生成NO
【解析】
(1)CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ/mol①,CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2②,将方程式①+②得2CH4(g)+4NO2(g)═2N2(g)+2CO2(g)+4H2O(g)△H=(-574+△H2)kJ/mol;16g甲烷的物质的量是1mol,根据方程式知,2mol甲烷完全反应放出热量(574-△H2)kJ热量,1mol甲烷完全反应放出867kJ热量,据此计算△H2;
(2)浓度均为0.1molL-1的Na2SO3、NaHSO3混合溶液中存在物料守恒,2n(Na)=3n(C);
(3)当达到化学平衡时满足v正=v逆,据此求算化学平衡常数表达式,根据消耗速率2v(N2O4)=v(NO2)判断化学平衡的点;
(4)①NH3与NO2生成N2的反应中,反应方程式为8NH3+6NO2=7N2+12H2O,该反应中生成7 mol N2时,转移的物质的量为8mol×3=24mol,据此计算生成1mol氮气转移电子物质的量;
②在一定温度范围内催化剂活性较大,超过其温度范围,催化剂活性降低;在温度、催化剂条件下,氨气能被催化氧化生成NO。
![]() ,
,![]() ,将方程式
,将方程式![]() 得:
得:![]() ;16g甲烷的物质的量是1mol,根据方程式知,2mol甲烷完全反应放出热量
;16g甲烷的物质的量是1mol,根据方程式知,2mol甲烷完全反应放出热量![]() 热量,1mol甲烷完全反应放出867kJ热量,
热量,1mol甲烷完全反应放出867kJ热量,![]() ,
,![]()
![]() ;
;
![]() 浓度均为
浓度均为![]() 的
的![]() 、
、![]() 混合溶液中存在物料守恒,
混合溶液中存在物料守恒,![]() ;
;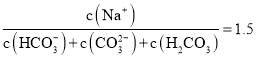 ,等浓度的亚硫酸钠和亚硫酸氢钠溶液中亚硫酸氢根离子电离程度大于其亚硫酸根离子水解,溶液显酸性,离子浓度:
,等浓度的亚硫酸钠和亚硫酸氢钠溶液中亚硫酸氢根离子电离程度大于其亚硫酸根离子水解,溶液显酸性,离子浓度: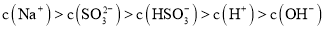 ;
;
![]() 当达到化学平衡时满足
当达到化学平衡时满足![]() ,即消耗速率
,即消耗速率![]() ,又有
,又有![]() ,
,![]() ,则
,则![]() 、
、![]() 与平衡常数
与平衡常数![]() 的关系为
的关系为![]() ;根据
;根据![]() ,则可以表示化学平衡的点为B点和D点;
,则可以表示化学平衡的点为B点和D点;
![]() 与
与![]() 生成
生成![]() 的反应中,反应方程式为
的反应中,反应方程式为![]() ,该反应中生成
,该反应中生成![]() 时,转移的物质的量为
时,转移的物质的量为![]() ,则生成1mol氮气转移电子物质的量
,则生成1mol氮气转移电子物质的量![]() ;
;
![]() 在一定温度范围内催化剂活性较大,超过其温度范围,催化剂活性降低,根据图知,迅速上升段是催化剂活性随温度升高增大,与温度升高共同使
在一定温度范围内催化剂活性较大,超过其温度范围,催化剂活性降低,根据图知,迅速上升段是催化剂活性随温度升高增大,与温度升高共同使![]() 去除反应速率迅速增大;上升阶段缓慢主要是温度升高引起的
去除反应速率迅速增大;上升阶段缓慢主要是温度升高引起的![]() 去除反应速率增大但是催化剂活性下降;在温度、催化剂条件下,氨气能被催化氧化生成NO,当反应温度高于
去除反应速率增大但是催化剂活性下降;在温度、催化剂条件下,氨气能被催化氧化生成NO,当反应温度高于![]() 时,
时,![]() 的去除率迅速下降的原因可能是氨气在该条件下与氧气反应生成NO。
的去除率迅速下降的原因可能是氨气在该条件下与氧气反应生成NO。