题目内容
【题目】短周期主族元素X、Y、Z、M、R、W的原子序数依次增大。X原子是周期表中半径最小的原子,Y原子的最外层电子数是其内层电子数的2倍,Z是地壳中含量最高的元素,M+、R2+与Z2-具有相同的电子层结构,W与M组成的化合物是生活中必备的调味品。根据题给信息按要求回答下列问题。
(1)元素Y在元素周期表中的位置为____________________。
(2)M、W各自的最高价氧化物对应水化物相互反应的离子方程式为_____。
(3)为比较M、R的活泼性,将其单质分别投入______(试剂)中,根据反应的剧烈程度,可证明活泼性强的是_______(填元素符号)。
(4)由Y与X组成的质量比为5∶1的有机物的化学式为__________,写出其所有分子的结构简式________________________________________________。
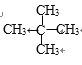
【答案】第2周期第ⅣA族 OH-+ H+=H2O H2O或等浓度的盐酸(硫酸) Na C5H12 CH3CH2CH2CH2CH3、![]() 、
、
【解析】
X原子是周期表中半径最小的原子,则X为H元素,Y原子的最外层电子数是其内层电子数的2倍,则Y为C元素,Z是地壳中含量最高的元素,则Z为O元素,M+、R2+与Z2-具有相同的电子层结构,则M为Na元素,R为Mg元素,W与M组成的化合物是生活中必备的调味品,W为Cl,据此分析答题。
(1)Y为C元素,在元素周期表中的位置为第2周期第ⅣA族;
(2)M为Na元素,W为Cl,M、W各自的最高价氧化物对应水化物分别为NaOH和HClO4,都是强电解质,相互反应的离子方程式为OH-+ H+=H2O;
(3) M为Na元素,R为Mg元素,为比较M、R的活泼性,将其单质分别投入水中或等浓度的稀盐酸(或稀硫酸)中,根据反应的剧烈程度,可证明活泼性强的是Na。
(4) X为H元素,Y为C元素,由Y与X组成的质量比为5∶1,设该有机物的分子式为CxHy,则12x:y=5:1,x:y=5:12,有机物的化学式为C5H12;由该分子是构成的有机物的名称分别为正戊烷、异戊烷和新戊烷,其所有分子的结构简式分别为:CH3CH2CH2CH2CH3、![]() 、
、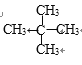 。
。

 名校课堂系列答案
名校课堂系列答案【题目】重铬酸钾(K2Cr2O7)为用途极广的铬化合物,供制铬矾。火柴、铬颜料、并供鞣革、电镀、有机合成等用。铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备K2Cr2O7晶体的过程如图所示:

根据题意回答下列问题:
(1)锻烧时,铬铁矿发生复杂反应生成Na2CrO4和NaFeO2,同时杂质SiO2、Al2O3与Na2CO3发生反应,其中Al2O3发生反应的化学方程式是___。
(2)NaFeO2遇水强烈水解生成滤渣l的反应离子方程式是___。
(3)滤液1和滤液2均需调节溶液pH,滤液1调节pH为7-8目的是___,滤液2调节pH约为5目的是___。
物质 | 溶解度/(g/100g水) | ||
0℃ | 40℃ | 80℃ | |
KCl | 28 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
Na2Cr2O7 | 163 | 215 | 376 |
(4)向Na2Cr2O7溶液中加入KCl固体,析出K2Cr2O7晶体。此法能够制得K2Cr2O7晶体的原因是:___;为了从溶液中得到较多K2Cr2O7晶体的操作过程是:___、过滤、洗涤、干燥。将得到的K2Cr2O7晶体进一步纯化操作是:___。
(5)K2Cr2O7性质:往K2Cr2O7溶液中加入AgNO3溶液,生成一种砖红色沉淀、溶液的pH减小,反应离子方程式是___。
(6)K2Cr2O7产品含量测定:准确称取试样2.5g配成250mL溶液,用移液管吸取25.00mL溶液放入碘量瓶,加入10mL2mol/L硫酸、2gKI于暗处5min,另加100mL水,用0.2000mol/L Na2S2O3标准液滴定至溶液黄绿色,再加3mL淀粉溶液继续滴定至蓝色褪去并呈亮绿色。平行三次实验,平均消耗Na2S2O3标准液的体积25.00mL。K2Cr2O7产品的纯度为___。
有关反应如下:K2Cr2O7+6KI+7H2SO4=Cr2(SO4)3+4K2SO4+3I2+7H2O
2Na2S2O3+I2=Na2S4O6+2NaI


