题目内容
19.在有机化工生产中,如图是合成某种聚酯纤维H的流程图.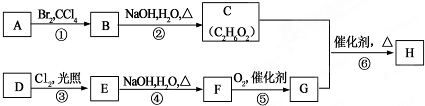
已知:A、D为烃,质谱图表明G的相对分子质量为166,其中含碳57.8%,含氢3.6%,其余为氧;G能与NaHCO3溶液反应且含有苯环;核磁共振氢谱表明E、G分子中均有两种类型的氢原子,且E分子中两种类型的氢原子的个数比为1:1.
已知乙二酸和乙二醇能发生如下反应:nHOOC-COOH+nHO-CH2CH2-OH?HO-[-OC-COO-CH2CH2-O-]nH+(2n-1)H2O
(1)①、③的反应类型依次为加成反应、取代反应;
(2)B的名称为:1,2-二溴乙烷;E的结构简式为:
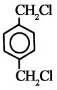 ;
;(3)写出下列化学方程式:②
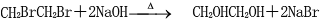 ⑥
⑥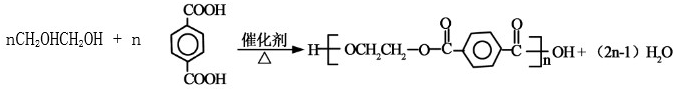 .
.
分析 A为烃,A和溴发生加成反应生成B,B和氢氧化钠的水溶液发生取代反应生成C,根据C的分子式知,C是乙二醇,则B是1,2-二溴乙烷,A是乙烯;
D为烃,质谱图表明G的相对分子质量为166,其中含碳元素57.8%,含氢元素3.6%,其余为氧元素,则D中碳氢氧的原子个数比=$\frac{57.8%}{12}$:$\frac{3.6%}{1}$:$\frac{1-57.8%-3.6%}{16}$=4:3:2,设G的化学式为(C4H3O2)x,(12×4+1×3+16×2)x=166,x=2,属于G的分子式为:C8H6O4,G能与NaHCO3溶液反应且含有苯环,说明G中含有羧基,G分子中含有两种类型的氢原子,G中含有苯环,属于G的结构简式为: ,F为对二苯甲醇,E分子中有两种类型的氢原子,且E分子中两种类型的氢原子的个数之比为1:1,E的结构简式为:
,F为对二苯甲醇,E分子中有两种类型的氢原子,且E分子中两种类型的氢原子的个数之比为1:1,E的结构简式为: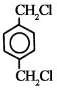 ,D是对二甲苯,乙二醇和对二苯甲酸反应生成聚酯纤维H,据此答题;
,D是对二甲苯,乙二醇和对二苯甲酸反应生成聚酯纤维H,据此答题;
解答 解:A为烃,A和溴发生加成反应生成B,B和氢氧化钠的水溶液发生取代反应生成C,根据C的分子式知,C是乙二醇,则B是1,2-二溴乙烷,A是乙烯;
D为烃,质谱图表明G的相对分子质量为166,其中含碳元素57.8%,含氢元素3.6%,其余为氧元素,则D中碳氢氧的原子个数比=$\frac{57.8%}{12}$:$\frac{3.6%}{1}$:$\frac{1-57.8%-3.6%}{16}$=4:3:2,设G的化学式为(C4H3O2)x,(12×4+1×3+16×2)x=166,x=2,属于G的分子式为:C8H6O4,G能与NaHCO3溶液反应且含有苯环,说明G中含有羧基,G分子中含有两种类型的氢原子,G中含有苯环,属于G的结构简式为: ,F为对二苯甲醇,E分子中有两种类型的氢原子,且E分子中两种类型的氢原子的个数之比为1:1,E的结构简式为:
,F为对二苯甲醇,E分子中有两种类型的氢原子,且E分子中两种类型的氢原子的个数之比为1:1,E的结构简式为: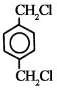 ,D是对二甲苯,乙二醇和对二苯甲酸反应生成聚酯纤维H,
,D是对二甲苯,乙二醇和对二苯甲酸反应生成聚酯纤维H,
(1)乙烯和溴发生加成反应生成1,2-二溴乙烷,对二甲苯和氯气发生取代反应生成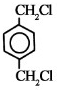 ,
,
故答案为:加成反应,取代反应;
(2)通过以上分析知,B是1,2-二溴乙烷,E的结构简式为: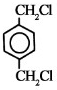 ,
,
故答案为:1,2-二溴乙烷;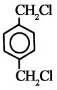 ;
;
(3)1,2-二溴甲烷和氢氧化钠的水溶液发生取代反应生成乙二醇,反应方程式为: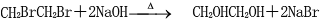 ,乙二醇和对二苯甲酸发生酯化反应生成聚酯纤维,反应方程式为:
,乙二醇和对二苯甲酸发生酯化反应生成聚酯纤维,反应方程式为: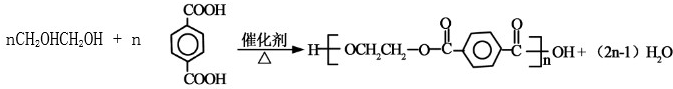 ,
,
故答案为: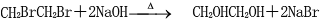 ,
,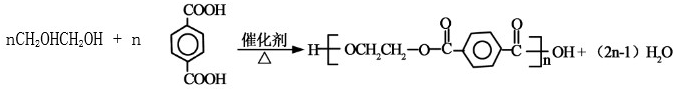 .
.
点评 本题考查有机物的推断,明确有机物的结构及其官能团是解本题关键,利用教材知识采用正推的方法进行分析,难点是同分异构体的确定,难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 第4周期第ⅠB族 | B. | 第5周期第ⅠB族 | C. | 第4周期第ⅥB族 | D. | 第5周期第ⅥB族 |
| A. | SO42-的空间构型是正四面体形 | |
| B. | CS2分子中各原子均达8电子稳定结构 | |
| C. | CH3-CH=CH2分子中碳原子的杂化类型有sp2和sp3两种 | |
| D. | H2O2分子是只含极性键的非极性分子 |
| A. | 增加C的用量 | B. | 增大反应体系的压强使体积改变 | ||
| C. | 升高体系的反应温度 | D. | 将容器的体积缩小一半 |
| A. | 相同温度下,0.02 mol•L-1的醋酸溶液与0.01 mol•L-1的醋酸溶液中的c(H+)之比小于2:1 | |
| B. | 相同温度下,0.1 mol•L-1 (NH4)2SO4溶液与0.1 mol•L-1NH4NO3溶液中c(NH4+)之比大于2:1 | |
| C. | 在0.1 mol•L-1NaOH溶液中逐滴加入0.1 mol•L-1CH3COOH溶液,当溶液pH=7时,加入CH3COOH溶液的体积与NaOH溶液的体积比小于2:1 | |
| D. | 40℃时,pH=7的(NH4)2SO4与NH3•H2O的混合溶液中c(NH4+)与c(SO42-)之比小于2:1 |
| A. | 氯气与水反应:Cl2+H2O=2H++Cl-+ClO- | |
| B. | 碳酸氢钙溶液加到盐酸中:Ca(HCO3)2+2HCl=Ca2++2CO2↑+2H2O | |
| C. | 少量金属钠加到冷水中:Na+2H2O=Na++OH-+H2↑ | |
| D. | 氢氧化铜加到盐酸中:Cu(OH)2+2H+=Cu2++2H2O |
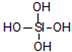 原硅酸的结构如图,若去掉氢原子后的剩余部分即SiO44-为原硅酸,其构型为正四面体,四面体顶角上的氧原子叫“角氧”.有关叙述正确的是( )
原硅酸的结构如图,若去掉氢原子后的剩余部分即SiO44-为原硅酸,其构型为正四面体,四面体顶角上的氧原子叫“角氧”.有关叙述正确的是( )| A. | 两分子原硅酸脱去一分子水得到的H6Si2O7分子中有6个Si-O键 | |
| B. | 两个硅氧四面体,彼此用一个角氧相连后,形成的Si2O76-离子中各键角均为109°28′ | |
| C. | 3个硅氧四面体彼此用3个角氧相连后,形成的Si3O96-离子呈链状 | |
| D. | n个硅氧四面体彼此用四个角氧连接后的晶体是二氧化硅 |
 汽车尾气中的主要污染物是NO和CO2.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气.
汽车尾气中的主要污染物是NO和CO2.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气.2NO(g)+2CO(g)═2CO2(g)+N2(g)△H1=-746.5kJ•mol-1
已知:2C(s)+O2(g)═2CO(G)△H2=-221kJ•mol-1
C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
则N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
(2)T℃下,在一容积不变的密闭容器中,通入一定量的NO和CO,用气体传感器测得不同时间NO和CO的浓度如下表:
| 时间/s | 0 | 2 | 3 | 4 | 5 |
| c(NO)/10-4mol•L-1 | 10.0 | c1 | 1.50 | 1.00 | 1.00 |
| c(CO)10-3mol•L-1 | 3.60 | c2 | 2.75 | 2.70 | 2.70 |
②前2s内的平均反应速率 v(CO2 )=3.75×10-4 mol/(L.s)
③不能作为判断该反应达到平衡状态的标志是ab.(填字母标号)
a.2v正(CO)=v疗(N2)
b.容器中混合气体的密度保持不变
c.容器中气体的压强不变
d.CO2的体积分数不变
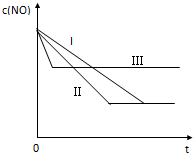
(3)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.根据下表设计的实验测得混合气体中NO的浓度随时间t变化的趋势如图所示:
| 实验 序号 | T/℃ | NO初始浓 度/10-3mol•L-1 | CO初始浓 度/10-3mol•L-1 | 催化剂的比表面积/㎡•g-1 |
| ① | 350 | 1.20 | 5.80 | 124 |
| ② | 280 | 1.20 | 5.80 | 124 |
| ③ | 280 | 1.20 | 5.80 | 82 |
(4)已知:CO通入新制的银氨溶液可生成银镜,同时释放一种能使湿润的红色石蕊试纸变蓝的气体.某温度下,向1L密闭容器中充入1molNO和1molCO,反应达到平衡后,将平衡混合气通入足量新制的银氨溶液中.生成43.2g Ag,则该温度下,反应:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+N2(g)的化学平衡常数K=160
(5)CO可作燃料电池的烯气.用Li2CO3和Na2CO3的熔融盐混合物做电解质,空气与CO2的混合气为正极助燃气,制得650℃下工作的燃料电池.该电池总反应为2CO+O2═2CO2,则负极反应式为2CO+2CO32--4e-═4CO2.
(1)已知H-Cl键的键能为431.4kJ/mol,下列关于键能的叙述正确的是AD.
A.每生成1mol H-Cl键放出431.4kJ能量
B.每生成1mol H-Cl键吸收431.4kJ能量
C.每拆开1mol H-Cl键放出431.4kJ能量
D.每拆开1mol H-Cl键吸收431.4kJ能量
(2)参考下表中的数据,判断下列分子受热时最稳定的是A.
| 化学键 | H-H | H-F | H-Cl | H-Br |
| 键能/kJ/mol | 436 | 565 | 431 | 368 |
(3)能用键能大小解释的是A.
A.氮气的化学性质比氧气稳定
B.常温常压下,溴呈液态,碘呈固态
C.稀有气体一般很难发生化学反应
D.硝酸易挥发而硫酸难挥发
(4)已知Cl-Cl键的键能是243kJ/mol,试求1mol H2在足量的Cl2中燃烧,理论上放出的热量是183 kJ(其他形式的能量很少,可忽略不计).