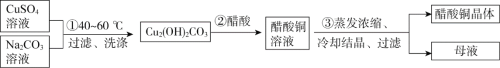
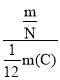题目内容
【题目】(1)标准生成热指的是在某温度下,由处于标准状态的各种元素的最稳定的单质生成标准状态下 1mol 某纯物质的热效应,单位常用 kJ/mol表示,已知在 25℃的条件下:
①Ag2O(s)+2HCl(g)═2AgCl(s)+H2O(l)△H=-324.4 kJ/mol
②2Ag(s)+ ![]() O2(g)═Ag2O(s)△H=-30.56kJ/mol
O2(g)═Ag2O(s)△H=-30.56kJ/mol
③ ![]() H2(g)+
H2(g)+ ![]() Cl2(g)═HCl(g)△H=-92.21 kJ/mol
Cl2(g)═HCl(g)△H=-92.21 kJ/mol
④H2(g)+ ![]() O2(g)═H2O(l)△H=-285.6 kJ/mol
O2(g)═H2O(l)△H=-285.6 kJ/mol
则25℃时氯化银的标准生成热为________ kJ/mol;
(2)实验测得 64g 甲醇[CH3OH(l)]在氧气中充分燃烧生成 CO2 气体和液态水时放出 1452.8kJ 的热量,则表示甲醇燃烧热的热化学方程式_________________;
(3)以甲烷、氧气为原料,KOH 为电解质,构成燃料电池,写出其负极的电极反应式:________;
(4)电解法制取有广泛用途的 Na2FeO4,工作原理如下图所示。
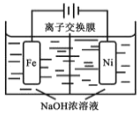
已知:Na2FeO4 只在强碱性条件下稳定。
①Na2FeO4能够净水的主要原因是_______________ 。
②阳极电极反应式 _______________;
③为使电解能较持久进行,应选用_______________ 离子交换膜(填“阴”或“阳”)。
【答案】-126.89 CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l)△H=-726.4kJ/mol CH4+2O2+2OH-=CO32-+3H2O Na2FeO4具有强氧化性,能够杀菌消毒,在杀菌消毒的过程中被还原为+3价的铁,水解生成具有强吸附性的氢氧化铁胶体,能够吸附水中杂质 Fe-6e-+8OH-═FeO42-+4H2O 阴
O2(g)=CO2(g)+2H2O(l)△H=-726.4kJ/mol CH4+2O2+2OH-=CO32-+3H2O Na2FeO4具有强氧化性,能够杀菌消毒,在杀菌消毒的过程中被还原为+3价的铁,水解生成具有强吸附性的氢氧化铁胶体,能够吸附水中杂质 Fe-6e-+8OH-═FeO42-+4H2O 阴
【解析】
(1)依据标准生成热指的是在某温度下,由处于标准状态的各种元素的最稳定的单质生成标准状态下1mol某纯物质的热效应,结合热化学方程式和盖斯定律计算分析得到;
(2)依据题干条件计算1mo甲醇燃烧放出的热量,依据热化学方程式的书写方法写出甲醇燃烧热的热化学方程式;
(3)原电池中负极上燃料失电子,碱性条件下,CH4反应生成碳酸根离子;
(4)①Na2FeO4中的铁元素为+6价,具有强氧化性,在杀菌消毒的过程中被还原为+3价的铁,能够水解生成氢氧化铁胶体,据此分析解答;②金属铁是阳极,该电极上金属铁发生失电子的氧化反应,在碱性条件下生成FeO42-;③Na2FeO4只在强碱性条件下稳定,电解过程中OH-向阳极移动,据此分析判断。
(1)①Ag2O(s)+2HCl(g)═2AgCl(s)+H2O(l)△H=-324.4 kJ/mol,②2Ag(s)+ ![]() O2(g)═Ag2O(s) △H=-30.56kJ/mol,③
O2(g)═Ag2O(s) △H=-30.56kJ/mol,③ ![]() H2(g)+
H2(g)+ ![]() Cl2(g)═HCl(g) △H=-92.21 kJ/mol,④H2(g)+
Cl2(g)═HCl(g) △H=-92.21 kJ/mol,④H2(g)+ ![]() O2(g)═H2O(l) △H=-285.6 kJ/mol,根据盖斯定律:将①+②+③×2-④得到:2Ag(s)+Cl2(s)=2AgCl(s) △H=-253.78kJ/mol,所以氯化银的标准生成热为
O2(g)═H2O(l) △H=-285.6 kJ/mol,根据盖斯定律:将①+②+③×2-④得到:2Ag(s)+Cl2(s)=2AgCl(s) △H=-253.78kJ/mol,所以氯化银的标准生成热为 ![]() ×(-253.78kJ/mol)=-126.89 kJ/mol,故答案为:-126.89;
×(-253.78kJ/mol)=-126.89 kJ/mol,故答案为:-126.89;
(2)64g液态甲醇在氧气中充分燃烧生成二氧化碳和液态水时,放出1452.8kJ的热量,则32g液态甲醇燃烧生成二氧化碳和液态水放热 ![]() ×1452.8kJ=726.4kJ,反应的热化学方程式为:CH3OH(l)+
×1452.8kJ=726.4kJ,反应的热化学方程式为:CH3OH(l)+ ![]() O2(g)=CO2(g)+2H2O(l) △H=-726.4kJ/mol,故答案为:CH3OH(l)+
O2(g)=CO2(g)+2H2O(l) △H=-726.4kJ/mol,故答案为:CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l) △H=-726.4kJ/mol;
O2(g)=CO2(g)+2H2O(l) △H=-726.4kJ/mol;
(3)原电池放电时,负极上甲烷失电子被氧化,电极反应式为:CH4+2O2+2OH-=CO32-+3H2O,故答案为:CH4+2O2+2OH-=CO32-+3H2O;
(4)①Na2FeO4中的铁元素为+6价,具有强氧化性,能够杀菌消毒,在杀菌消毒的过程中被还原为+3价的铁,水解生成具有强吸附性的氢氧化铁胶体,能够吸附水中的细微悬浮物形成沉淀,所以是一种“绿色、环保、高效”净水剂,故答案为:Na2FeO4具有强氧化性,能够杀菌消毒,在杀菌消毒的过程中被还原为+3价的铁,水解生成具有强吸附性的氢氧化铁胶体,能够吸附水中杂质;
②根据图示,金属铁是阳极,该电极上金属铁发生失电子的氧化反应,即Fe-6e-+8OH-═FeO42-+4H2O,故答案为:Fe-6e-+8OH-═FeO42-+4H2O;
③Na2FeO4只在强碱性条件下稳定,电解过程中OH-向阳极移动,则应选择阴离子交换膜,故答案为:阴。