题目内容
1.质量、物质的量.物质的量浓度等是用于化学计算的常见物理量.(1)同温同压下,A2气体与B2气体等体积化合,生成AxBy气体,已知反应前后气体的密度不变,则AxBy的分子式为AB.
(2)有一只干燥的烧瓶,在标准状况下用排空气法收集HCl,测得烧瓶内气体在相同状况下对CH4的相对密度为2,则烧瓶内气体的平均摩尔质量为32g/mol,空气与HCl的体积比为3:2.然后将该烧瓶倒置于水槽中,已知HCl全部溶解且假设溶质不从烧瓶中扩散出来,那么烧瓶中盐酸的物质的量浓度为$\frac{1}{22.4}$mol/L.
(3)将a L Al2(SO4)3和(NH4)2SO4的混合溶液分成两等份,一份加入b mol BaCl2溶液使溶液中的SO42-刚好完全沉淀;另一份加入足量NaOH溶液并加热可得到C mol NH3,则原溶液中Al3+的物质的量浓度为$\frac{4b-2c}{3a}$mol/L.
(4)将0.24g Mg和0.27g Al的混合物投入到100mL 1mol/L的盐酸中,充分反应后固体完全溶解.向所得溶液中加入2mol/L的NaOH溶液,恰好使金属离子全部沉淀完全.写出加入NaOH溶液发生的相关离子方程式H++OH-=H2O、Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,需要NaOH溶液的体积为50mL.
(5)常温下A和B两种气体组成的混合物(A的摩尔质量大于B的摩尔质量),经分析混合气体中只含有C、O元素:
①当混合物中C、O的质量比总是小于3:8时,混合气体中A和B分别是CO2、O2.
②当混合物中C、O的质量比为1:2时,混合气体中A的体积百分数为50%或20%.
分析 (1)相同温度和压强下,气体的体积之比等于物质的量之比等于化学反应方程式的系数之比,据此书写方程式,再利用化学反应遵循原子守恒推断;
(2)根据“烧瓶内气体在相同状况下对CH4的相对密度为2”计算出烧瓶内气体的平均摩尔质量;设出空气和氯化氢的体积,根据相同条件下体积之比等于物质的量之比列式计算出空气与HCl的体积比;设出烧瓶的体积,根据n=$\frac{V}{{V}_{m}}$、c=$\frac{n}{V}$计算出烧瓶中盐酸的物质的量浓度;
(3)根据SO42-+Ba2+═BaSO4↓计算溶液中的SO42-离子的物质的量,根据NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O计算NH4+的物质的量,再根据c=$\frac{n}{V}$计算SO42-离子、NH4+离子浓度,再利用电荷守恒有3n(Al3+)+c(NH4+)=2c(SO42-),据此计算原溶液中的Al3+浓度;
(4)根据n=$\frac{m}{M}$计算出镁和铝的物质的量,再根据n=cV计算出氯化氢的物质的量,结合反应关系式判断HCl是否有剩余;根据判断结果,若氯化氢过量,则加入氢氧化钠溶液后剩余的氯化氢优先反应,然后镁离子和铝离子与氢氧化钠反应生成沉淀,据此写出反应的离子方程式;根据镁离子、铝离子恰好沉淀时的溶质为NaCl计算出消耗氢氧化钠的物质的量,再根据V=$\frac{n}{c}$计算出消耗NaOH溶液的体积;
(5)①根据已知条件,确定物质范围;根据氧的相对原子质量与碳的相对原子质量比,分别计算出CO2、O2和CO中氧,碳元素的质量比,再根据要求进行组合;
②当混合物中C、O的质量比为1:2时,CO2分子中C、O质量之比=3:8<1:2,CO分子中C、O元素的质量比=12:16=3:4>1:2,O2中C、O元素的质量比=0<1:2,
所以该混合气体可能为CO2和CO或CO和O2,根据相对分子质量大小判断A、B,然后设出A、B的物质的量,根据C、O的质量比为1:2列式计算.
解答 解:(1)相同温度和压强下,气体的体积之比等于物质的量之比,等于化学反应方程式的系数之比,所以1体积的X2气体与1体积的Y2气体化合生成2体积的气态化合物Z,反应方程式可以表示为:X2+Y2=2Z,根据原子守恒可知Z为XY,
故答案为:AB;
(2)有一只干燥的烧瓶,在标准状况下用排空气法收集HCl,测得烧瓶内气体在相同状况下对CH4的相对密度为2,气体的摩尔质量与相对密度成正比,则烧瓶内气体的平均摩尔质量为:16g/mol×2=32g/mol;设空气的体积为x、HCl的体积为y,则:$\frac{29x+36.5y}{x+y}$=32,解得:x:y=3:2,即:空气与HCl的体积比为3:2;
将该烧瓶倒置于水槽中,已知HCl全部溶解且假设溶质不从烧瓶中扩散出来,设烧瓶的容积为VL,则烧瓶中含有标准状况下HCl的体积为:VL×$\frac{2}{3+2}$=0.4VL,其物质的量为:$\frac{0.4VL}{22.4L/mol}$=$\frac{0.4V}{22.4}$mol,烧瓶中溶液体积为0.4VL,所以烧瓶中盐酸的物质的量浓度为:$\frac{\frac{0.4V}{22.4}mol}{0.4VL}$=$\frac{1}{22.4}$mol/L,
故答案为:32g/mol;3:2;$\frac{1}{22.4}$mol/L;
(3)将Al2(SO4)3和(NH4)2SO4的混合溶液a L分为两等份,每份的体积为0.5a,
向0.5aL混合溶液中加入bmolBaCl2,恰好使溶液中的SO42-离子完全沉淀,则:
SO42-+Ba2+═BaSO4↓
bmol bmol
c(SO42-)=$\frac{bmol}{0.5aL}$=$\frac{2b}{a}$mol/L,
向0.5aL混合溶液中加入足量强碱并加热可得到cmolNH3,则:
NH4++OH- $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O
cmol cmol
c(NH4+)=$\frac{cmol}{0.5aL}$=$\frac{2c}{a}$mol/L,
又溶液不显电性,设原溶液中的Al3+浓度为x,由电荷守恒可知,
x×3+$\frac{2c}{a}$mol/L×1=$\frac{2b}{a}$mol×2,
解得:x=$\frac{4b-2c}{3a}$mol/L,
故答案为:$\frac{4b-2c}{3a}$mol/L;
(4)0.24g Mg的物质的量为:$\frac{0.24g}{24g/mol}$=0.01mol,0.27g Al的物质的量为:$\frac{0.27g}{27g/mol}$=0.01mol,100mL 1mol/L的盐酸中含有HCl的物质的量为:1mol/L×0.1L=0.1mol,0.01molMg完全反应消耗0.02molHCl,0.01molAl完全反应消耗0.02molHCl,总共消耗了0.05molHCl,说明反应后盐酸有剩余,故向所得溶液中加入2mol/L的NaOH溶液,盐酸先参与反应生成氯化钠和水,然后镁离子、铝离子分别为氢氧化钠反应分别生成氢氧化镁、氢氧化铝沉淀,反应的离子方程式有:H++OH-=H2O、Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓;恰好使金属离子全部沉淀完全时,溶质为NaCl,根据质量守恒可知:n(NaOH)=n(NaCl)=n(HCl)=0.1mol,需要NaOH溶液的体积为:$\frac{0.1mol}{2mol/L}$=0.05L=50mL,
故答案为:H++OH-=H2O、Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓;50;
(5)①由C、O元素组成的气体有:CO2、O2和CO,
CO2中C、O元素的质量比是12:36=3:8;
CO中C、O元素的质量比是12:16=3:4;
O2中C、O元素的质量比为0;
当混合物中C、O的质量比总是小于3:8,说明该混合气体是CO2和O2的混合气体,
又因为A的相对分子质量大于B的相对分子质量,故A为二氧化碳,B为氧气,
故答案为:CO2;O2;
②当混合物中C、O的质量比为1:2时,CO2分子中C、O质量之比=3:8<1:2,
CO分子中C、O元素的质量比=12:16=3:4>1:2,
O2中C、O元素的质量比=0<1:2,
所以该混合气体可能为CO2和CO或CO和O2,
当为CO和O2时,则A为O2,B为CO,设混合气体中O2和CO的物质的量分别为x、y,则:$\frac{12y}{16(2x+y)}$=$\frac{1}{2}$,解得:x:y=1:4,相同条件下气体体积之比等于物质的量之比,则混合气体中氧气的体积分数为:$\frac{1}{1+4}$×100%=20%;
当混合气体为CO2和CO时,A为CO2、B为CO,设CO2和CO的物质的量分别为x、y,则:$\frac{12(x+y)}{16(2x+y)}$=$\frac{1}{2}$,解得:x:y=1:1,相同条件下气体体积之比等于物质的量之比,则混合气体中氧气的体积分数为:$\frac{1}{1+1}$×100%=50%,
故答案为:50%或20%.
点评 本题考查了混合物的计算、物质的量的计算,题目难度中等,明确物质的量与摩尔质量、物质的量浓度等之间的关系为解答关键,试题知识点较多、计算量较大,充分考查了学生的分析、理解能力及化学计算能力.

 阅读快车系列答案
阅读快车系列答案| A. | 质子数为7、中子数为8的氮原子:${\;}_{7}^{8}$N | |
| B. | 氮离子(N3-)的结构示意图: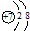 | |
| C. | 氨分子的电子式: | |
| D. | 硝基苯的结构简式: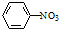 |
| A. | 氯气是既不是电解质,也不是非电解质,但其水溶液却可以导电 | |
| B. | Al2O3和MgO都是属于离子化合物,熔沸点都很高,故工业上常用熔点较低的AlCl3和MgCl2来冶炼金属 | |
| C. | H2O是分子晶体,晶体中含氢键,其熔沸点一般比同主族的氢化物要高 | |
| D. | 分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液 |
| A. | 除去N2中的少量O2:通过灼热的CuO粉末,收集气体 | |
| B. | 除去CO2中的少量HCl:通入过量NaOH溶液,收集气体 | |
| C. | 除去KCl溶液中少量MgCl2:加入适量NaOH溶液,过滤 | |
| D. | 除去NaCl溶液中少量CaCl2:加入过量Na2CO3溶液,过滤,滤液中再加入过量盐酸,加热 |
| A. | 57.5mL | B. | 55mL | C. | 52.5mL | D. | 50mL |
| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA | |
| C. | 欲配制1.00L 1.00mol•L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中 | |
| D. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA |
