题目内容
【题目】随着科学技术的发展和环保要求不断提高,CO2的捕集利用技术成为研究的重点。
Ⅰ.工业上使用的捕碳剂有NH3和(NH4)2CO3,它们与CO2可发生如下可逆反应:
NH3(l)+H2O(l)+CO2(g)![]() NH4HCO3(aq) ΔH1
NH4HCO3(aq) ΔH1
2NH3(l)+H2O(l)+CO2(g)![]() (NH4)2CO3(aq) ΔH2
(NH4)2CO3(aq) ΔH2
(NH4)2CO3(aq)+H2O(l)+CO2(g)![]() 2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3
则ΔH3=_________________(用含ΔH1、ΔH2的代数式表示)。
Ⅱ.目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的化学反应方程式为CO2(g)+4H2(g)![]() CH4(g)+2H2O(g),已知:H2的体积分数随温度的升高而增加。
CH4(g)+2H2O(g),已知:H2的体积分数随温度的升高而增加。
(1)该反应的ΔS________0(填“>”“<”或“=”),该反应的ΔH________0(填“>”或“<”)。
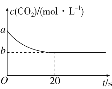
(2)在恒容密闭容器中通入等物质的量的CO2和H2并发生上述反应,T ℃下,CO2物质的量浓度c(CO2)随时间t变化的曲线如图所示。下列能说明反应达到平衡状态的是________(填字母代号)。
A.体系压强保持不变
B.混合气体密度保持不变
C.甲烷和水蒸气的物质的量之比保持不变
D.H2的质量分数保持不变
(3)T℃下,反应前20 s的平均反应速率v(H2)=______________(用含a、b的代数式表示)。
(4)T℃下,该反应的平衡常数K=_________________________(用含a、b的代数式表示)。
(5)若降低温度,反应重新达到平衡,则v(正)________;CO2转化率________(填“增大”“减小”或“不变”)。
Ⅲ.工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图所示:
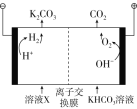
(1)在阳极区发生的反应包括___________________________________和H++HCO3-=CO2↑+H2O。
(2)简述CO32-在阴极区再生的原理:____________________________。
(3)NH3·BH3+3H2O2=NH4BO2+4H2O。下列说法正确的是___________。
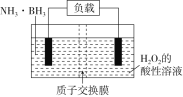
A.电流从左侧电极经过负载后流向右侧电极
B.BO2-通过质子交换膜向正极移动
C.负极附近溶液pH增大
D.正极的反应式为3H2O2+6H++6e-=6H2O
【答案】2ΔH1-ΔH2 < < AD ![]() mol/(L·s)
mol/(L·s) ![]() 减小 增大 4OH--4e-=2H2O+O2↑或2H2O-4e-=4H++O2↑ 阴极H+放电产生H2,OH-浓度变大并与HCO3-反应使CO32-再生 D
减小 增大 4OH--4e-=2H2O+O2↑或2H2O-4e-=4H++O2↑ 阴极H+放电产生H2,OH-浓度变大并与HCO3-反应使CO32-再生 D
【解析】
I.①NH3(l)+H2O(l)+CO2(g)![]() NH4HCO3(aq) ΔH1
NH4HCO3(aq) ΔH1
②2NH3(l)+H2O(l)+CO2(g)![]() (NH4)2CO3(aq) ΔH2
(NH4)2CO3(aq) ΔH2
③(NH4)2CO3(aq)+H2O(l)+CO2(g)![]() 2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3
利用盖斯定律计算①×2-②得到(NH4)2CO3(aq)+H2O(l)+CO2(g)![]() 2NH4HCO3(aq) ΔH3=2ΔH1-ΔH2;
2NH4HCO3(aq) ΔH3=2ΔH1-ΔH2;
Ⅱ.(1)该反应正反应方向气体分子数减少,则ΔS<0,已知H2的体积分数随温度的升高而增加,说明温度升高,平衡逆向移动,正反应方向为放热反应,则ΔH<0;
(2)A.该反应前后气体分子数不等,反应过程中体系压强发生变化,当体系压强不变时,说明反应达到平衡状态,故A正确;
B.反应前后气体总质量不变,容器体积不变,气体密度始终不变,不能说明反应达到平衡状态,故B错误;
C.从反应开始到平衡,甲烷和水蒸气的物质的量之比均为1:2,始终不变,不能说明反应达到平衡状态,故C错误;
D.H2的质量分数保持不变,说明正逆反应速率相等,反应达到平衡状态,故D错误;
故答案选:AD;
(3)由图1可知:反应前20秒CO2的物质的量浓度减少(a-b)mol/L,则H2物质的量浓度减少4(a-b)mol/L,平均速率![]() mol/(L·s);
mol/(L·s);
(4)起始时通入等物质的量的CO2和H2,二者的起始浓度相等,均为a mol/L,减少的浓度分别为(a-b) mol/L和4(a-b) mol/L,平衡浓度分别为b mol/L、(4b-3a)mol/L,CH4和水蒸气的平衡浓度分别为(a-b) mol/L和2(a-b) mol/L,该反应的平衡常数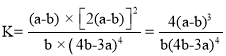 ;
;
(5)降低温度,v(正)减小,平衡正向移动,CO2转化率增大;
Ⅲ.(1)由图2可知:阳极区OH-失电子生成O2,电极反应式为![]() 或
或![]() ;
;
(2)阴极的电极反应为![]() ,c(H+)减小,电离平衡
,c(H+)减小,电离平衡![]() 正向移动,可以使CO32-再生;
正向移动,可以使CO32-再生;
(3)由反应NH3·BH3+3H2O2=NH4BO2+4H2O可知H2O2中氧元素化合价下降发生还原反应,为原电池的正极,NH3·BH3中B元素化合价升高,发生氧化反应,为原电池的负极。
A. 电流从正极流向负极,即从右侧电极经过负载后流向左侧电极,故A错误;
B. 放电时,阴离子向负极移动,所以BO2通过质子交换膜向负极移动,故B错误;
C. NH3BH3为负极失电子发生氧化反应,电极反应式为![]() ,所以负极附近溶液pH减小,故C错误;
,所以负极附近溶液pH减小,故C错误;
D. 右侧H2O2为正极得到电子发生还原反应,电极反应式为![]() ,故D正确;
,故D正确;
故答案选:D。

 阅读快车系列答案
阅读快车系列答案