题目内容
20.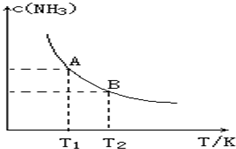 在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25.0%.
在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25.0%.(1)当温度由T1变化到T2时,平衡常数关系K1>K2(填“>”,“<”或“=”),焓变△H<0.(填“>”或“<”)
(2)该反应在T1温度下5.0min达到平衡,这段时间内N2的化学反应速率为0.008mol/(L.min).N2的转化率40%
(3)T1温度下该反应的化学平衡常数K1=18.3.
(4)T1温度时,若测得高炉中c(N2)=0.5mol/L,c(H2)=0.5mol/L,c(NH3)=0.5mol/L在这种情况下,该反应是否处于平衡状态否(填是或否),此时反应速率是v正>v逆(填>,<,=).
分析 (1)由图可知,温度越高,平衡时NH3的浓度越小,说明升高温度平衡向逆反应进行,平衡常数减小;
(2)将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,温度为T1时平衡混合气体中氨气的体积分数为25.0%,则:
N2(g)+3H2(g)?2NH3(g)
开始(mol):1 3 0
变化(mol):n 3n 2n
平衡(mol):1-n 3-3n 2n
所以$\frac{2n}{4-2n}$=25%,解得n=0.4
根据v=$\frac{△c}{△t}$计算v(N2),N2的转化率=$\frac{消耗的氮气物质的量}{氮气起始物质的量}$×100%;
(3)根据K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$计算平衡常数;
(4)计算此时浓度商Qc,若Qc=K,处于平衡状态,若Qc<K,反应向正反应进行,若Qc>K,反应向逆反应进行,进而判断v正、v逆相对大小.
解答 解:(1)由图可知,温度越高,平衡时NH3的浓度越小,说明升高温度平衡向逆反应进行,平衡常数减小,故平衡常数关系K1>K2,而升高温度平衡向吸热反应移动,故正反应为放热反应,则△H<0,
故答案为:>;<;
(2)将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,温度为T1时平衡混合气体中氨气的体积分数为25.0%,则:
N2(g)+3H2(g)?2NH3(g)
开始(mol):1 3 0
变化(mol):n 3n 2n
平衡(mol):1-n 3-3n 2n
所以$\frac{2n}{4-2n}$=25%,解得n=0.4
故v(N2)=$\frac{\frac{0.4mol}{10L}}{5min}$=0.008mol/(L.min),N2的转化率=$\frac{0.4mol}{1mol}$×100%=40%,
故答案为:0.008mol/(L.min);40%;
(3)T1温度下该反应的化学平衡常数K1=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$=$\frac{(\frac{0.8}{10})^{2}}{\frac{0.6}{10}×(\frac{1.8}{10})^{3}}$≈18.3,
故答案为:18.3;
(4)此时浓度商Qc=$\frac{0.{5}^{2}}{0.5×0.{5}^{3}}$=4<K=18.3,未处于平衡状态,反应向正反应进行,则v正>v逆,
故答案为:否;>.
点评 本题考查化学平衡计算、反应速率计算、平衡常数计算及应用,难度中等,注意理解掌握平衡常数的应用.

| A. | 物质的量就是数量,只是描述对象为微观粒子 | |
| B. | 摩尔质量在数值上等于相对原子(或分子)质量,所以HCl的摩尔质量为36.5 | |
| C. | 阿伏伽德罗常数约为6.02×1023 | |
| D. | 物质的量是一个物理量,它将宏观的质量或体积与微观的粒子数联系起来 |
| A. | 同主族金属的原子半径越大,熔点越高 | |
| B. | 分子间作用力越强,分子晶体的熔点越高 | |
| C. | 稀有气体原子序数越大,熔点越低 | |
| D. | 同周期元素的原子半径越小,越易失去电子 |
| T/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{[CO]•[{H}_{2}O]}{[C{O}_{2}]•[{H}_{2}]}$.
(2)若反应在830℃下达到平衡,则CO2气体的转化率为33.3%.
(3)若绝热时(容器内外没有热量交换),平衡发生移动的结果是使容器内CO的浓度增大,则容器内气体温度降低(填“升高”、“降低”或“不能确定”).
(4)能判断该反应是否达到化学平衡状态的依据是BC(填字母序号).
A.容器内压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
E.c(CO2 )•c(H2)=c(CO)•c(H2O)
请找
| A | B | C | |
| 浓度1 | 0.05mol•L-1 | amol•L-1 | 0.05mol•L-1 |
| 浓度2 | 0.078mol•L-1 | 0.078mol•L-1 | 0.122mol•L-1 |
| 浓度3 | 0.06mol•L-1 | 0.06mol•L-1 | 0.04mol•L-1 |
| 浓度4 | 0.07mol•L-1 | 0.07mol•L-1 | 0.098mol•L-1 |
| A. | 由[浓度3]与[浓度1]的比较,可判断出正反应是放热反应 | |
| B. | 由[浓度2]与[浓度1]的比较,可判断平衡移动的原因是升高温度 | |
| C. | [浓度1]中a=0.05mol•L-1 | |
| D. | 该组某学生在实验①过程中,测得各物质在某一时刻的浓度为[浓度4].与[浓度1]比较,可发现该同学在测定[浓度4]这组数据时出现了很大的误差 |
| A. | 40% | B. | 50% | C. | 70% | D. | 90% |
| A. | 稀硫酸与氢氧化钾溶液的反应 | B. | 氢气还原氧化铜的反应 | ||
| C. | 锌与稀硫酸的反应 | D. | 生石灰变成熟石灰的反应 |
| A. | 常温下,pH=3的HX(一元酸)溶液与pH=11的YOH(一元碱)溶液等体积混合,所得溶液的pH一定大于或等于7 | |
| B. | 在相同温度下,浓度均为0.1 mol•L-1的(NH4)2Fe(SO4)2和(NH4)2SO4溶液中,c(NH4+)相同 | |
| C. | 在pH<7的CH3COOH和CH3COONa的混合液中,c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 0.4 mol•L-1盐酸与0.1 mol•L-1NaAlO2溶液等体积混合,所得溶液中:c(Cl-)>c(Na+)>c(Al3+)>c(H+)>c(OH-) |
