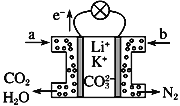
题目内容
【题目】I、二氧化硫是常用的工业原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
已知:硫酸生产中,将SO2催化氧化成SO3的化学方程式为:2SO2+O2![]() 2SO3。将2.0mol SO2和1.0mol O2置于10L密闭容器中,在300℃和500℃条件下得到如图所示图象 回答下列问题:
2SO3。将2.0mol SO2和1.0mol O2置于10L密闭容器中,在300℃和500℃条件下得到如图所示图象 回答下列问题:

①300℃时,平衡常数K=________,升高温度,K值______(填“增大”、“减小”或“不变”)。
②在500℃时,从反应开始到平衡,氧气的平均反应速率v(O2)=______________。
③在其他条件不变的情况下,对处于E点的反应体系,体积压缩到原来的1/2,下列有关该体系的说法正确的是________。
A.氧气的浓度减少 B.正反应速率加快,逆反应速率也加快
C.SO3的物质的量增加 D.重新平衡时,n(O2)/n(SO3)增大
④已知2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-196.64kJ·mol-1,在一定温度下,向一固定容积的密闭容器中通入2molSO2、1molO2,达到平衡时放出热量为Q1kJ,在同样条件下,向该容器中通入2molSO3,达到平衡时,吸收热量为Q2kJ,则Q1和Q2的关系为_________________。
2SO3(g) ΔH=-196.64kJ·mol-1,在一定温度下,向一固定容积的密闭容器中通入2molSO2、1molO2,达到平衡时放出热量为Q1kJ,在同样条件下,向该容器中通入2molSO3,达到平衡时,吸收热量为Q2kJ,则Q1和Q2的关系为_________________。
II、如图所示,向A中充入 1mol X和1mol Y,向B中充入 2mol X和2mol Y,起始时VA=VB=aL。在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:X+Y![]() 2Z+W;(四物质均为气体)。达到平衡时VA=1.2a L,试回答:(A在的活塞可移动)A、B中X的转化率αA ______αB(填“>、=、<”)。
2Z+W;(四物质均为气体)。达到平衡时VA=1.2a L,试回答:(A在的活塞可移动)A、B中X的转化率αA ______αB(填“>、=、<”)。

III、现有反应:mA(g)+nB(g)![]() pC(g),达平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)若加入B(体积不变),则A的转化率______。
(2)若升高温度,则平衡时B、C的浓度之比![]() 将________。
将________。
(3)若加入催化剂,平衡时气体混合物的总物质的量__________。
(4)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色________,
而维持容器内压强不变,充入氖气时,混合物颜色______(填“变深”、“变浅”或“不变”)。
(5)在固定容积的密闭容器中能说明反应己达平衡状态的是______________。
A.浓度pc(B)=nc(C) B.容器内压强保持不变
C.pv逆(B)=n v正(C) D.容器内的密度保持不变
【答案】 800 减小 0.0125mol·L-1·min-1 BC Q1+Q2=196.64kJ 〉 增大 变小 不变 变深 变浅 BC
【解析】I、①将2.0mol SO2和1.0mol O2置于10L密闭容器中,300℃达到平衡时n(SO3)=1.6mol,则:
2SO2(g)+O2(g)2SO3(g)
起始浓度(mol/L):0.2 0.1 0
变化浓度(mol/L):0.16 0.08 0.16
平衡浓度(mol/L):0.04 0.02 0.16
故平衡常数K= =
=![]() =800;由表中数据可知,升高温度,三氧化硫的物质的量减小,说明升高温度平衡逆向移动,平衡常数减小,故答案为:800;减小;
=800;由表中数据可知,升高温度,三氧化硫的物质的量减小,说明升高温度平衡逆向移动,平衡常数减小,故答案为:800;减小;
②500℃达到平衡时n(SO3)=1.5mol,根据方程式可知△n(O2)= ![]() △n(SO3)=0.75mol,平衡时氧气物质的量=1mol-0.75mol=0.25mol,故平衡时氧气浓度为
△n(SO3)=0.75mol,平衡时氧气物质的量=1mol-0.75mol=0.25mol,故平衡时氧气浓度为![]() =0.025mol/L,氧气的平均反应速率v(O2)=
=0.025mol/L,氧气的平均反应速率v(O2)=![]() =0.0125 mol·L-1·min-1,故答案为:0.0125 mol·L-1·min-1;
=0.0125 mol·L-1·min-1,故答案为:0.0125 mol·L-1·min-1;
③在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,则压强增大,正逆反应速率都增大,平衡向正向移动,三氧化硫的物质的量增多,氧气的物质的量减小,但由于体积减小,平衡时氧气的浓度反而增大,根据浓度比值等于物质的量比值,则有重新平衡时n(O2)/n(SO3)减小,即BC正确,故答案为:BC;
④向一固定容积的密闭容器中通入2molSO2和1molO2和向该容器中通入2molSO3,建立的平衡是等效的,Q1+Q2=196.64,故答案为:Q1+Q2=196.64;
II、B装置是在等容条件下,反应向正反应方向移动时,混合气体的物质的量增大,导致容器内气体压强增大,增大压强能抑制X的转化率,所以X的转化率减小,所以B容器中X的转化率比A小;故答案为:>;
III、达到平衡后,当升高温度时,B的转化率变大,说明温度升高平衡向正反应方向移动,则正反应为吸热反应;当减小压强时,混合体系中C的质量分数也减小,说明压强减小平衡向逆反应方向移动,则方程式中反应物的气体的计量数之和大于生成物气体的化学计量数之和。
(1)在反应容器中加入一定量的B,反应物B的浓度增大,平衡向正反应方向移动,则A的转化率增大,故答案为:增大;
(2)正反应吸热,则升高温度平衡向正反应方向移动,B的物质的量减小,C的物质的量增多,所以二者的浓度比值将减小,故答案为:变小;
(3)催化剂对化学平衡移动没有影响,所以若加入催化剂,平衡时气体混合物的总物质的量不变,故答案为:不变;
(4)B是有色物质,A、C均无色,则加入C(体积不变)时,平衡逆向移动,B的浓度增大,则混合物颜色变深;而维持容器内压强不变,充入氖气时,则体积增大,所以混合物颜色变浅,故答案为:变深;变浅;
(5)A.浓度pc(B)=nc(C)不表示浓度不变,可能是反应过程中的一个特殊点,不能说明反应己达平衡状态,错误;B.该反应属于气体的物质的量变化的反应,容器内压强保持不变说明气体的物质的量不变,能够说明反应己达平衡状态,正确;C.pv逆(B)=n v正(C)表示正逆反应速率相等,能够说明反应己达平衡状态,正确;D.该反应中气体的质量和容器的体积不变,容器内的密度始终保持不变,不能说明反应己达平衡状态,错误;故选BC。