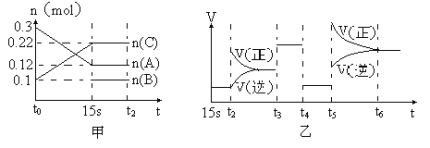
题目内容
【题目】下列叙述正确的是( )
A. 标准状况下,11.2LSO2气体中含氧原子数等于18g水中含有的氧原子数
B. 5.6 g铁与足量稀硫酸反应失去的电子的物质的最为0.3 mol
C. 100g98%的浓硫酸所含的氧原子个数为4mol
D. 20gNaOH溶于1L水,所得溶液中c(Na+)=0.5mol·L-1
【答案】A
【解析】A.标准状况下,11.2LSO2的物质的量=![]() =0.5mol,含有1mol氧原子,18g水的物质的量=
=0.5mol,含有1mol氧原子,18g水的物质的量=![]() =1mol,也含有1molO原子,故二者含有的氧原子数相等,故A正确;B.Fe与硫酸反应生成硫酸亚铁,硫酸足量,Fe完全反应,5.6gFe的物质的量=
=1mol,也含有1molO原子,故二者含有的氧原子数相等,故A正确;B.Fe与硫酸反应生成硫酸亚铁,硫酸足量,Fe完全反应,5.6gFe的物质的量=![]() =0.1mol,反应中Fe元素化合价由0价升高为+2价,故转移电子物质的量=0.1mol×2=0.2mol,故B错误;C.100g98%的浓硫酸中含有98g硫酸和2g水,其中水中也含有氧原子,故C错误;D.20gNaOH的物质的量=
=0.1mol,反应中Fe元素化合价由0价升高为+2价,故转移电子物质的量=0.1mol×2=0.2mol,故B错误;C.100g98%的浓硫酸中含有98g硫酸和2g水,其中水中也含有氧原子,故C错误;D.20gNaOH的物质的量=![]() =0.5mol,溶于水配成1L溶液,所得溶液中c(Na+)=0.5mol/L,体积1L是指溶液的体积,不是溶剂的体积,故D错误;答案为A。
=0.5mol,溶于水配成1L溶液,所得溶液中c(Na+)=0.5mol/L,体积1L是指溶液的体积,不是溶剂的体积,故D错误;答案为A。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案【题目】汽车尾气脱硝脱碳主要原理为:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) △H<0。在一定条件下的密闭容器中,用传感器测得该反应在不同时间NO和CO浓度如下表:
N2(g)+2CO2(g) △H<0。在一定条件下的密闭容器中,用传感器测得该反应在不同时间NO和CO浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 |
C(NO)/mol L-1 | 9.50×10-3 | 4.50×10-3 | 2.50×10-5 | 1.50×10-3 | 1.5×10-3 |
C(CO)/mol L-1 | 9.00×10-3 | 4.00×10-3 | 2. 00×10-3 | 1.00×10-3 | .1.00×10-3 |
下列说法正确的是
A. —定温度下,从开始到平衡,该反应的平衡常数逐渐增大
B. 前2s内的平均反应速率v(N2) = 1.75×10-3 mol·L-1·s-1
C. 达到平衡时,CO的转化率为11. 11%
D. 3s时NO和CO的浓度都不再变化,反应停止进行