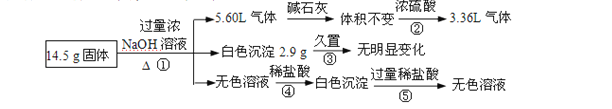
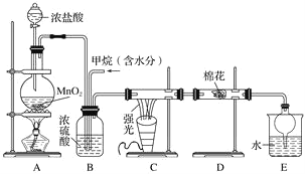
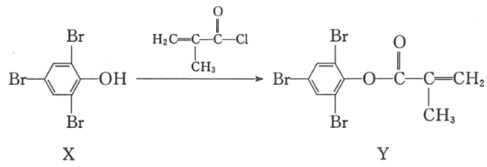
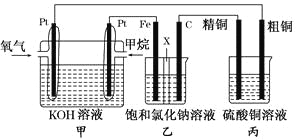
题目内容
【题目】在浓度均为3mol·L-1的H2SO4和NaOH溶液各100 mL中,分别加入等质量的铝粉,反应完毕后生成气体的质量比为4∶5,则加入铝粉的物质的量为( )
A.0.125molB.0.25molC.0.5molD.1mol
【答案】B
【解析】
Al与硫酸、氢氧化钠溶液反应的方程式为:2Al+3H2SO4=Al2(SO4)3+3H2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑,n(H2SO4)=n(NaOH)=3mol/L×0.1L=0.3mol。
若铝粉在两溶液中均不足,则反应生成气体的质量之比为1:1;
若铝粉在两溶液中均过量,则生成气体的质量之比为2:3。
而现在反应完毕后生成气体的质量之比为4:5,介于1:1和2:3之间,说明铝在一种溶液中不足,在另一种溶液中过量。根据反应方程式2Al+3H2SO4=Al2(SO4)3+3H2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知,铝在NaOH溶液中不足,在硫酸中过量,据此分析。
若铝粉在两溶液中均不足,则反应生成气体的质量之比为1:1;
若铝粉在两溶液中均过量,则生成气体的质量之比为3:2。
而现在反应完毕后生成气体的质量之比为4:5,介于1:1和2:3之间,说明铝在一种溶液中不足,在另一种溶液中过量。
根据反应方程式2Al+3H2SO4=Al2(SO4)3+3H2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知,铝在NaOH溶液中不足,在硫酸中过量。
Al与硫酸反应产生氢气按不足量的硫酸为标准计算,n(H2SO4)=n(NaOH)=3mol/L×0.1L=0.3mol,则根据方程式2Al+3H2SO4=Al2(SO4)3+3H2↑可知反应产生氢气的物质的量n(H2)=n(H2SO4)=0.3mol,由于Al与酸、碱反应产生氢气的质量比为4∶5,由n=![]() 可知对于同一气体,质量比等于体积比等于气体的物质的量的比,则二者反应产生的氢气的物质的量比为4∶5,Al与酸反应产生0.3molH2,则与碱反应产生H2的物质的量为n(H2)=
可知对于同一气体,质量比等于体积比等于气体的物质的量的比,则二者反应产生的氢气的物质的量比为4∶5,Al与酸反应产生0.3molH2,则与碱反应产生H2的物质的量为n(H2)=![]() ×0.3mol=0.375mol,根据方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知n(Al):n(H2)=2:3,n(H2)=0.375mol,则n(Al)=
×0.3mol=0.375mol,根据方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知n(Al):n(H2)=2:3,n(H2)=0.375mol,则n(Al)=![]() n(H2)=
n(H2)=![]() ×0.375mol=0.25mol,故合理选项是B。
×0.375mol=0.25mol,故合理选项是B。

【题目】某兴趣小组制备氢氧化亚铁沉淀。
实验1 |
| 实验现象 |
液面上方产生白色絮状沉淀,迅速变为灰绿色,振荡,试管壁上有红褐色沉淀生成。 |
(1)实验1中产生白色沉淀的离子方程式是_______。
(2)为了探究沉淀变灰绿色的原因,该小组同学展开如下探究:
①甲同学推测灰绿色物质为Fe(OH)2和Fe(OH)3混合物。查阅资料后根据调色原理认为白色和红褐色的调和色不可能是灰绿色,并设计实验证实灰绿色物质中不含有Fe(OH)3,方案是______。
②乙同学查阅文献:Fe(OH)2在大量SO42-存在的情况下形成Fe6(SO4)2(OH)4O3(一种灰绿色氧基碱式复盐)。并设计对比实验证实该假设:向试管中加入________,再往试管中加入_________,振荡,现象与实验1相同,结论是该假设不成立。
③乙同学继续查阅文献:Fe(OH)2沉淀具有较强的吸附性能,灰绿色可能是由Fe(OH)2表面吸附Fe2+引起。推测所用的硫酸亚铁溶液的浓度应越小越好;氢氧化钠溶液浓度应越大越好。设计了如下实验方案:
试管中10mLNaOH溶液 | 滴加FeSO4溶液 | 实验现象 | |
实验2 | 6 mol/LNaOH溶液 | 0.2mol/L FeSO4溶液 | 产生悬浮于液面的白色沉淀(带有少量灰绿色),沉淀下沉后,大部分灰绿色变为白色沉淀 |
实验3 | 6 mol/LNaOH溶液 | 0.1mol/L FeSO4溶液 | 产生悬浮于液面的白色沉淀(带有极少量灰绿色),沉淀下沉后,底部都为白色沉淀 |
该实验得出的结论是________。丙同学认为该实验方案不足以证明灰绿色是由Fe(OH)2表面吸附Fe2+引起的,还需补充的实验是__________,证明该假设成立。
(3)根据以上实验探究,若尽可能制得白色Fe(OH)2沉淀,需要控制的实验条件_____。
(4)下列情况会导致所配NaOH溶液的浓度偏高的是_______。
A.NaOH溶液未冷却至室温就进行定容 B.配制前容量瓶中有少量的水
C.配制溶液时,俯视容量瓶刻度线 D.加水时超过刻度线,用胶头滴管吸出