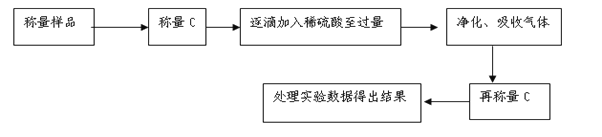
题目内容
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:
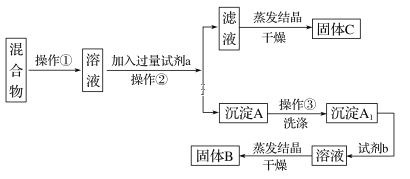
供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作②的名称是__________,试剂a的溶质是__________(填化学式)。
(2)加入试剂b所发生反应的化学方程式为___________________。
(3)洗涤沉淀A的方法____________________。
(4)该方案能不能达到实验目的__________,若不能,应如何改进?(若能,此问不用回答)__________________ 。
【答案】过滤 K2CO3 BaCO3+2HCl=BaCl2+CO2↑+H2O 沿玻璃棒向过滤器中加入蒸馏水至浸没沉淀,待水自然流下后,重复2-3次,直至洗涤干净即可(或向过滤器中加入蒸馏水至浸没沉淀,待水自然流下后,重复2-3次,直至洗涤干净即可) 不能 应在操作②的滤液中加入过量盐酸后再蒸发结晶
【解析】
分离KCl和BaCl2两种固体混合物,可先溶于水,然后加入过量K2CO3使BaCl2转化为沉淀,过滤后向沉淀加入盐酸可生成BaCl2溶液,经蒸发、结晶、干燥后可得固体BaCl2,操作②所得滤液为KCl和K2CO3的混合物,应加入过量盐酸使K2CO3发生反应,可得纯净的KCl,以此解答该题。
(1)将固体溶解在水中配成溶液,向该溶液中加入过量K2CO3溶液,发生反应:K2CO3+BaCl2=BaCO3↓+2KCl,操作②为固体和液体的分离,操作名称为过滤,试剂a的溶质为K2CO3;
(2)沉淀A是BaCO3,向该沉淀中加入蒸馏水没过沉淀,对沉淀洗涤,得到沉淀A1为纯净BaCO3,然后加入稀盐酸,使沉淀发生溶解,发生反应:BaCO3+2HCl=BaCl2+CO2↑+H2O;
(3)洗涤沉淀A的方法是沿玻璃棒向过滤器中加入蒸馏水至浸没沉淀,待水自然流下后,重复2-3次,直至洗涤干净即可或向过滤器中加入蒸馏水至浸没沉淀,待水自然流下后,重复2-3次,直至洗涤干净即可;
(4)在操作②过滤得到的滤液中含有KCl和过量K2CO3,滤液为KCl和K2CO3的混合物,直接将该溶液蒸发结晶、干燥,得到的固体C是KCl和K2CO3的混合物,因此不能达到分离KCl和BaCl2两种固体混合物的目的。改进方法是在操作②的滤液中加入过量盐酸,使K2CO3与HCl发生反应:K2CO3+2HCl=2KCl+ CO2↑+H2O,然后再蒸发结晶,就可以得到纯净的KCl。

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案【题目】下列实验操作,现象和结论都正确的是
选项 | 操作 | 现象 | 结论 |
A | 用坩埚钳夹一块铝箔在酒精灯上灼烧 | 铝箔熔化并滴落 | 氧化铝的熔点较低 |
B | 向亚硫酸钠溶液中滴加足量盐酸,将产生的气体通入品红溶液 | 品红溶液褪色 | 非金属性: |
C | 将用砂纸除去保护膜的镁片和铝片(大小、形状相同),分别插入同浓度的稀硫酸中 | 镁片表面产生气泡速率大于铝片 | 还原性: |
D | 常温下,将两根大小相同的铁钉分别插入浓硝酸和稀硝酸中 | 浓硝酸中无明显现象,稀硝酸中产生气泡 | 稀硝酸的氧化性比浓硝酸强 |
A.AB.BC.CD.D