题目内容
【题目】25℃时,将0.1molL﹣1 NaOH溶液加入20mL0.1molL﹣1CH3COOH溶液中,所加入溶液的体积(V)和混合液的pH关系曲线如图所示。下列结论正确的是( )
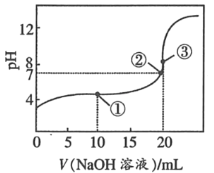
A.①点时,c(CH3COO﹣)+c(CH3COOH)=c(Na+)
B.对曲线上①②③任何一点,溶液中都有c(Na+)+c(H+)=c(OH﹣)+c(CH3COO﹣)
C.③点时,醋酸恰好完全反应完溶液中有c(CH3COO﹣)=c(Na+)>c(H+)=c(OH﹣)
D.滴定过程中可能出现c(H+)>c(Na+)>c(CH3COO﹣)>c(OH﹣)
【答案】B
【解析】
①点溶液中溶质为等物质的量浓度的CH3COONa和CH3COOH,混合溶液中存在物料守恒,根据物料守恒判断;任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;②点溶液呈中性,溶质为CH3COONa和CH3COOH,但CH3COOH较少③点溶液中溶质为CH3COONa,溶液的pH>7,溶液呈碱性。
A、①点溶液中溶质为等物质的量浓度的CH3COONa和CH3COOH,混合溶液中存在物料守恒,根据物料守恒得c(CH3COO﹣)+c(CH3COOH)=2c(Na+),故A错误;
B、任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(OH﹣)+c(CH3COO﹣),所以滴定过程中①②③任一点都存在电荷守恒c(Na+)+c(H+)=c(OH﹣)+c(CH3COO﹣),故B正确;
C、③点溶液中溶质为CH3COONa,溶液的pH>7,溶液呈碱性,则c(H+)<c(OH﹣),根据电荷守恒得c(Na+)>c(CH3COO﹣),盐类水解程度较小,所以存在c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+),故C错误;
D、滴定过程中遵循电荷守恒,如果溶液呈酸性,则c(H+)>c(OH﹣),根据电荷守恒得c(Na+)<c(CH3COO﹣),故D错误;
答案选B。