题目内容
下列叙述正确的是
| A.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊试液呈红色 |
| B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 |
| C.pH=2与pH=1的硝酸中c(H+)之比为10:1 |
D.向0.1 mol/L的氨水中加入少量醋酸铵固体,则溶液中 增大 增大 |
A
A:PH之和为14的酸碱等体积混合,谁弱呈谁性,最终溶液呈酸性,滴入石蕊试液呈红色,正确(严格来讲,石蕊的变色范围是5—8,本题考虑的也不是很全面)。
B:如果醋酸为一元强酸,选项正确,但它为弱酸,由c(H+)=cα,可知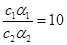 ,由于稀释促进电离导致
,由于稀释促进电离导致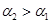 ,所以c1>10c2
,所以c1>10c2
C:pH为c(H+)的负对数,所以pH=2与pH=1的硝酸中c(H+)之比为1:10
D:向0.1 mol/L的氨水中加入少量醋酸铵固体,抵制了氨水的电离,故 减小。
减小。
B:如果醋酸为一元强酸,选项正确,但它为弱酸,由c(H+)=cα,可知
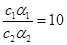 ,由于稀释促进电离导致
,由于稀释促进电离导致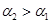 ,所以c1>10c2
,所以c1>10c2C:pH为c(H+)的负对数,所以pH=2与pH=1的硝酸中c(H+)之比为1:10
D:向0.1 mol/L的氨水中加入少量醋酸铵固体,抵制了氨水的电离,故
 减小。
减小。
练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
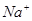
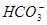
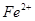
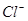
 H+ + A2-。
H+ + A2-。 OH-)>c(HA-)>c(H+)
OH-)>c(HA-)>c(H+)