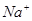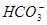题目内容
浓度均为0.1 mol·L-1的三种溶液:①CH3COOH溶液,②氢氧化钠溶液 ③醋酸钠溶液,下列说法不正确的是( )
| A.①和②等体积混合后的溶液中:c(OH-)=c(H+)+c(CH3COOH) |
| B.①和③等体积混合后溶液显酸性:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| C.②和③等体积混合后溶液中由水电离出的c(H+)<10-7 mol/L |
| D.由水电离出的c(OH-):②>③>① |
D
物质的量浓度相等的CH3COOH溶液和氢氧化钠溶液等体积混合后所得的溶液相当于醋酸钠的水溶液,根据醋酸钠溶液中质子守恒可以得到c(OH-)=c(H+)+c(CH3COOH),A正确,不选;CH3COOH溶液与醋酸钠溶液等体积混合,由于醋酸电离出CH3COO-和H+,所以溶液显酸性,溶液中离子溶度大小关系为c(CH3COO-)>c(Na+)>c(H+)>c(OH-),B正确;氢氧化钠溶液和醋酸钠溶液等体积混合,溶液由于存在氢氧化钠而显碱性,属于碱的溶液,酸碱都会抑制水的电离,所以c(H+)<10-7 mol/L,C正确;醋酸钠溶液由于存在CH3COO-的水解会促进水的电离所以③中水电离出的c(OH-)最大,酸碱都会抑制水的电离,等浓度时氢氧化钠是强碱抑制的程度大于弱酸CH3COOH,所以水电离出的c(OH-)应该为③>①>②,D错误;答案选D。

练习册系列答案
相关题目