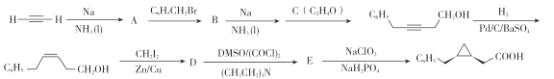
题目内容
【题目】某药物丙可由有机物甲和乙在一定条件下反应制得:
![]() (甲)+
(甲)+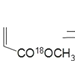 (乙)
(乙)![]()
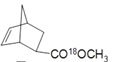 (丙)
(丙)
下列说法正确的是
A.甲与乙生成丙的反应属于加成反应
B.甲分子中所有原子共平面
C.乙的化学式是C4H718OO
D.丙在碱性条件下水解生成 ![]() 和 CH318OH
和 CH318OH
【答案】A
【解析】
A.通过分析反应前后物质的结构可知,反应过程中甲分子发生了1,4加成,形成了一个新的碳碳双键,乙分子也发生了加成最终与甲形成了六元环;A项正确;
B.由于甲分子中存在一个sp3杂化的形成了4条单键的碳原子,所以甲分子内的所有原子不可能共平面;B项错误;
C.由乙的结构可知,乙的分子式为:![]() ;C项错误;
;C项错误;
D.酯在碱性条件下水解,产物羧酸会与碱反应生成羧酸盐,所以丙在碱性条件下水解的产物为![]() 和
和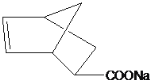 ,D项错误;
,D项错误;
答案选A。

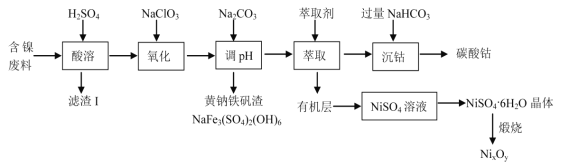
【题目】某实验室以含镍废料(主要成分为NiO,还含有少量 FeO、Fe2O3、CoO、BaO 和SiO2)为原料制备NixOy 和碳酸钴(CoCO3)的工艺流程如图:
已知有关氢氧化物开始沉淀和沉淀完全的 pH 如表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Ni(OH)2 |
开始沉淀的 pH | 1.5 | 6.5 | 7.2 | 7.7 |
沉淀完全的 pH | 3.7 | 9.7 | 9.4 | 9.2 |
请回答以下问题:
(1)“滤渣Ⅰ”主要成分为(填化学式)_____。
(2)“氧化”时(加入 NaClO3)的离子方程式为_____。
(3)加入 Na2CO3 来“调 pH”的目的是生成黄钠铁钒沉淀而除去铁,也可通过加入MO(对应的金属氧化物)来调节 pH 将铁除去,则 pH 控制的范围为_____。
(4)在实验室萃取操作应该在_____中完成(填仪器名称),向水相中加入NaHCO3 时的离子方程式为_________。
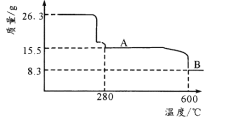
(5)从 NiSO4 溶液获得NiSO4·6H2O 晶体的操作依次是:_____,_________,过滤,洗涤,干燥。“煅烧”时剩余固体质量与温度变化曲线如图,该曲线中 B 段所表示氧化物的名称为_____。
【题目】X、Y、Z、W、R、P、Q是短周期主族元素,部分信息如下表所示:
X | Y | Z | W | R | P | Q | |
原子半径/nm | 0.154 | 0.074 | 0.099 | 0.075 | 0.143 | ||
主要化合价 | -4,+4 | -2 | -1,+7 | -3,+5 | +3 | ||
其他 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(1)R在自然界中有质量数为35和37的两种核素,它们之间的关系是互为___。
(2)Z的单质与水反应的化学方程式是___;R与Q两元素最高价氧化物水化物反应的离子方程式___。
(3)Y与R相比,非金属性较强的是___(用元素符号表示),下列事实能证明这一结论的是___(填字母序号)。
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价
(4)写出工业制取Y的单质的化学方程式___。
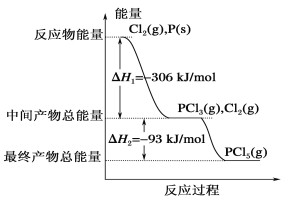
(5)反应3X2(g)+P2(g)![]() 2PX3(g)过程中的能量变化如图所示回答下列问题:
2PX3(g)过程中的能量变化如图所示回答下列问题:
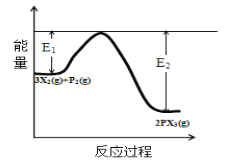
①该反应是___反应(填“吸热”“放热”);
②反应体系中加入催化剂对反应热是否有影响?___,原因是___(从能量说明)