题目内容
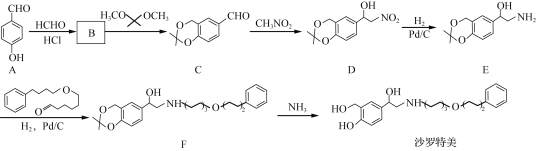
【题目】红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如下图所示(中的ΔH表示生成1 mol 产物的数据)。
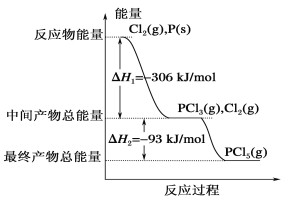
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是_____。
(2)PCl5(g)=PCl3(g)+Cl2(g) ΔH2=_____
(3)P和Cl2分两步反应生成1 mol PCl5的ΔH3=__,P和Cl2一步反应生成1molPCl5的ΔH4____(填“大于”“小于”或“等于”)ΔH3。
【答案】![]() Cl2(g)+P(s)=PCl3(g) ΔH=-306 kJ·mol-1 +93kJ·mol-1 -399kJ·mol-1 等于
Cl2(g)+P(s)=PCl3(g) ΔH=-306 kJ·mol-1 +93kJ·mol-1 -399kJ·mol-1 等于
【解析】
(1)根据图象得出反应物、生成物以及反应热=生成物的总能量-反应物的总能量,然后依据书写热化学方程式的原则书写;
(2)根据图象得出反应物、生成物以及反应热=生成物的总能量-反应物的总能量,然后依据书写热化学方程式的原则书写;
(3)根据盖斯定律分析,根据反应物的总能量、中间产物的总能量以及最终产物的总能量,结合化学方程式以及热化学方程式的书写方法解答,注意盖斯定律的应用。
(1)根据图示可知:P(s)+![]() Cl2(g)═PCl3(g),反应物的总能量大于生成物的总能量,该反应是放热反应,反应热为△H=-306 kJ/mol,则热化学方程式为:P(s)+
Cl2(g)═PCl3(g),反应物的总能量大于生成物的总能量,该反应是放热反应,反应热为△H=-306 kJ/mol,则热化学方程式为:P(s)+![]() Cl2(g)═PCl3(g)△H=-306 kJ/mol;
Cl2(g)═PCl3(g)△H=-306 kJ/mol;
(2)根据图示可知:Cl2(g)+PCl3(g)═PCl5(g),中间产物的总能量大于最终产物的总能量,该反应是放热反应,△H=生成物总能量-反应物总能量=-93 kJ/mol;所以PCl5(g)═PCl3(g)+Cl2(g)是吸热反应;热化学方程式为PCl5(g)═PCl3(g)+Cl2(g)△H=+93 kJ/mol;
(3)根据盖斯定律,P和Cl2分两步反应和一步反应生成PCl5的△H应该是相等的,P和Cl2分两步反应生成1 molPCl5的热化学方程式:P(s)+3/2Cl2(g)═PCl3(g)△H1=-306 kJ/mol,Cl2(g)+PCl3(g)═PCl5(g)△H2=-93 kJ/mol;P和Cl2一步反应生成1molPCl5的△H3=-306 kJ/mol+(-93 kJ/mol)=-399 kJ/mol;由图象可知,P和Cl2分两步反应生成1molPCl5的△H3=-306kJ/mol-(+93kJ/mol)=399kJ/mol,根据盖斯定律可知,反应无论一步完成还是分多步完成,生成相同的产物,反应热相等,则P和Cl2一步反应生成1molPCl5的反应热等于P和Cl2分两步反应生成1molPCl5的反应热。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案