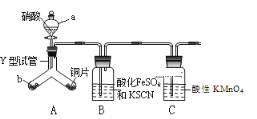
题目内容
【题目】为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):

(1)操作Ⅰ需要用到的玻璃仪器有________,操作Ⅱ的名称是________。
(2)试剂①、②、③其实是三种物质:饱和Na2CO3溶液、BaCl2溶液、NaOH溶液,这三种物质的加入顺序可能有多种情况,下列选项中正确的是________。
A.饱和Na2CO3溶液、BaCl2溶液、NaOH溶液
B.BaCl2溶液、饱和Na2CO3溶液、NaOH溶液
C.NaOH溶液、BaCl2溶液、饱和Na2CO3溶液
D.饱和Na2CO3溶液、NaOH溶液、BaCl2溶液
(3)固体丁是混合物,除含有泥沙、CaCO3、BaSO4外,还含有________(填化学式)。
(4)在混合物乙中分别加入试剂①、②、③的过程中,判断滴加BaCl2溶液已过量的方法是:加入BaCl2溶液后,静置,在上层清液中,________。
(5)若先用适量盐酸调节pH值再进行操作Ⅰ,将对实验结果产生影响,其原因是______。
【答案】烧杯、漏斗、玻璃棒 蒸发结晶 BC Mg(OH)2、BaCO3 继续滴加BaCl2溶液,若无浑浊,则表明BaCl2已过量 会使之前步骤中为去除杂质而形成的沉淀再次溶解,导致不能达到提纯的目的。(其它合理答案也可以)
【解析】
(1)根据实验流程和原理,操作Ⅰ为过滤,结合过滤操作所用到的仪器来作答;操作Ⅱ是分离氯化钠溶液中的氯化钠;
(2)除去镁离子选用氢氧化钠,除去钙离子选用碳酸钠,除去硫酸根离子选用氯化钡,所加试剂要过量,为了将多余的杂质除掉,碳酸钠除将钙离子沉淀,还将过量的钡离子沉淀下来;碳酸钠必须放在氯化钡之后加入;
(3)经过除杂剂除杂后根据发生的离子反应可知,得到的难溶性物质有:CaCO3、BaSO4和Mg(OH)2、BaCO3;
(4)根据钡离子能和硫酸根之间反应生成硫酸钡沉淀来检验氯化钡是否过量;
(5)Mg(OH)2、CaCO3、BaCO3会与盐酸反应,生成氯化镁、氯化钙、氯化钡等物质,会影响制得精盐的纯度。
(1)当加完除杂剂以后,操作Ⅰ为过滤,目的是为了分离上述操作得到的难溶性物质和氯化钠溶液,用到的玻璃仪器为:烧杯、漏斗、玻璃棒,操作Ⅱ目的是想从溶液中分离氯化钠精盐,该方法是蒸发结晶,
故答案为:烧杯、漏斗、玻璃棒;蒸发结晶;
(2)除杂试剂为了完全除去杂质离子,一般是过量的,碳酸钠可以将钙离子以及过量的钡离子沉淀下来,饱和Na2CO3溶液、BaCl2溶液、NaOH溶液,这三种物质的加入顺序必须满足饱和Na2CO3溶液放在BaCl2溶液之后加入,则可以依次是BaCl2溶液、饱和Na2CO3溶液、NaOH溶液或者NaOH溶液、BaCl2溶液、饱和Na2CO3溶液,
故答案为:BC;
(3)粗盐和各除杂剂发生的离子方程式分别是为:SO42-+Ba2+=BaSO4↓,CO32-+Ba2+=BaCO3↓,CO32-+Ca2+=CaCO3↓,Mg2++2OH- = Mg(OH)2↓;因此,过滤之后得到的固体丁除含有泥沙、CaCO3、BaSO4外,还应有Mg(OH)2、BaCO3,
故答案为:Mg(OH)2、BaCO3;
(4)过量的氯化钡会将全部的硫酸根离子沉淀完毕,只要是硫酸根剩余,则氯化钡会与其反应出现白色沉淀,所以判断BaCl2已过量的方法是:向上层清液(或取少量上层清液于试管中),继续滴入适量BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量,
故答案为:继续滴加BaCl2溶液,若无浑浊,则表明BaCl2已过量
(5)若先用适量盐酸调节pH值再进行过滤操作,那样之前生成的不溶于水但溶于酸的沉淀均会与盐酸反应,生成易溶于水的氯化镁、氯化钙、氯化钡等物质,从而达不到提纯精盐的目的,
故答案为:会使之前步骤中为去除杂质而形成的沉淀再次溶解,导致不能达到提纯的目的。(其它合理答案也可以)

【题目】无机化合物可根据其组成和性质进行分类:

(1)上述所示的物质分类方法名称是________。
(2)
物质 类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学 式 | ①HCl ②_______ | ③_____ ④Ba(OH)2 | ⑤Na2CO3 ⑥_______ | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O2 |
以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在上表中②③⑥的后面。
(3)写出⑦转化为⑤的化学方程式:__________________________。
(4)写出实验室由⑩制备O2的化学方程式:__________________________________________________。
(5)实验室制备⑦常用________与________反应,检验该气体的方法是__________________________________。
【题目】用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
(1)已知:N2(g)+O2(g) = 2NO(g)△H=+180.5kJ/mol,N2(g)+3H2(g) ![]() 2NH3(g)△H=-92.4kJ/mol,2H2(g)+O2(g) = 2H2O(g) △H=-483.6kJ/mol,写出氨气经催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为_________。
2NH3(g)△H=-92.4kJ/mol,2H2(g)+O2(g) = 2H2O(g) △H=-483.6kJ/mol,写出氨气经催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为_________。
(2)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2。
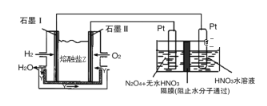
写出石墨I电极上发生反应的电极反应式_______________________________,在电解池中生成N2O5的电极反应式为__________________________________。
(3)以甲醇燃料电池为电源,用惰性电极电解饱和NaCl溶液时,每消耗0.2mol CH3OH,阴极产生标况下气体的体积为________L。
(4)在一定体积的密闭容器中,进行如下化学反应: N2(g)+3H2(g) ![]()
![]() 2NH3(g),其化学平衡常数K与温度t的关系如下表:
2NH3(g),其化学平衡常数K与温度t的关系如下表:
t/K | 298 | 398 | 498 | … |
K/(mol·L-1)2 | 4.1106 | K1 | K2 | … |
完成下列问题:
①已知该反应能够自发进行,试比较K1、K2的大小:K1_______ K2(填“>”、“=”或“<”);
②在同温同压时判断该反应达到化学平衡状态的依据是_________(填序号);
A.2v(H2)(正)=3v(NH3)(逆) B.2v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(5)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。
①写出盐酸肼第一步水解反应的离子方程式__________________________________;
②盐酸肼水溶液中离子浓度的排列顺序不正确的是__________(填序号)。
A.c(Cl-)>c(N2H62+)> c(OH-)> c(H+)
B.c(Cl-)>c([N2H5·H2O]+)> c(H+)>c(OH-)
C.2 c(N2H62+)+ c([N2H5·H2O]+)+c(H+)= c(Cl-)+c(OH-)
D.c(N2H62+)> c(Cl-)>c(H+)>c(OH-)