题目内容
【题目】现有常温条件下甲、乙、丙三种溶液,甲为0.1 mol/L的NaOH溶液,乙为0.1 mol/L的HCl溶液,丙为0.1 mol/L的CH3COOH溶液,试回答下列问题:
(1)甲溶液的pH=__________;
(2)丙溶液中存在电离平衡为_____________、______________(用电离方程式表示);
(3)某同学用甲溶液分别滴定20.00 mL乙溶液和 20.00 mL丙溶液,得到如图所示两条滴定曲线,请完成有关问题:
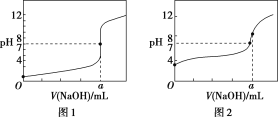
①甲溶液滴定丙溶液的曲线是________(填“图1”或“图2”);
②a=________。
【答案】13 CH3COOH ![]() CH3COO-+H+ H2O
CH3COO-+H+ H2O![]() OH-+H+ 图2 20.00
OH-+H+ 图2 20.00
【解析】
(1)0.1molL-1的NaOH溶液中c(OH-)=0.1mol/L,故根据水的离子积常数可知溶液中c(H+)=1×10-13mol/L,因此该溶液的pH=-lg10-13=13;
(2)0.1molL-1的CH3COOH溶液中存在溶剂水,水为弱电解质,溶质乙酸为弱电解质,因此存在电离平衡为CH3COOH![]() CH3COO-+H+、H2O
CH3COO-+H+、H2O![]() OH-+H+;
OH-+H+;
(3)①醋酸为弱电解质,滴定过程中pH变化较盐酸缓慢,滴定终点时溶液呈碱性,则滴定醋酸溶液的曲线是图2;
②滴定终点时n(CH3COOH)=n(NaOH),则a=20.00mL,反应生成了醋酸钠,醋酸根离子发生水解,CH3COO-+H2O![]() CH3COOH+OH-,溶液显示碱性pH>7。
CH3COOH+OH-,溶液显示碱性pH>7。

【题目】在硫酸工业中,通过下列反应使SO2氧化成SO3:2SO2(g)+O2(g) ![]() 2SO3(g)ΔH=-198kJ·mol-1。下表为不同温度和压强下SO2的转化率(%)
2SO3(g)ΔH=-198kJ·mol-1。下表为不同温度和压强下SO2的转化率(%)
| 1×105 | 5×105 | 1×106 | 5×106 | 1×107 |
450 | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
550 | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
(1)实际生产中,选定400~500℃作为操作温度,其原因是_______________________。
(2)实际生产中,采用的压强为常压,其原因是__________________________________。