题目内容
【题目】无机化合物可根据其组成和性质进行分类:

(1)上述所示的物质分类方法名称是________。
(2)
物质 类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学 式 | ①HCl ②_______ | ③_____ ④Ba(OH)2 | ⑤Na2CO3 ⑥_______ | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O2 |
以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在上表中②③⑥的后面。
(3)写出⑦转化为⑤的化学方程式:__________________________。
(4)写出实验室由⑩制备O2的化学方程式:__________________________________________________。
(5)实验室制备⑦常用________与________反应,检验该气体的方法是__________________________________。
【答案】树状分类法 H2SO4(或HNO3等) NaOH(或KOH等) Na2SO4(或K2CO3、Na2SO3、NaNO3等) 2NaOH+CO2(少量)Na2CO3+H2O 2H2O2![]() 2H2O+O2↑ 稀盐酸 大理石(或石灰石) 将反应产生的气体通入澄清石灰水中,若变浑浊即可证明是CO2
2H2O+O2↑ 稀盐酸 大理石(或石灰石) 将反应产生的气体通入澄清石灰水中,若变浑浊即可证明是CO2
【解析】
(1)根据图示可知,该物质分类方法名称是树状分类法;综上所述,本题答案是:树状分类法。
(2)②根据提供的元素可知,常见的酸有H2SO4、HNO3等;综上所述,本题答案是:H2SO4(或HNO3等)。
③根据提供的元素可知,常见的碱有NaOH、KOH等;综上所述,本题答案是:NaOH(或KOH等)。
⑥根据提供的元素可知,常见的盐有NaCl、Na2SO4、Na2CO3、NaNO3、Na2SO3等;综上所述,本题答案是:Na2SO4(或K2CO3、Na2SO3、NaNO3等) 。
(3)二氧化碳与足量碱反应可以生成碳酸钠:化学方程式:2NaOH+CO2(少量)Na2CO3+H2O;综上所述,本题答案是:2NaOH+CO2(少量)Na2CO3+H2O。
(4)双氧水在催化剂作用下分解为氧气,化学方程式:2H2O2![]() 2H2O+O2↑;综上所述,本题答案是:2H2O2
2H2O+O2↑;综上所述,本题答案是:2H2O2![]() 2H2O+O2↑。
2H2O+O2↑。
(5) 制备CO2常利用大理石或石灰石(CaCO3)与稀盐酸的反应CaCO3+2HClCaCl2+CO2↑+H2O,将产生的气体通入澄清石灰水,若变浑浊即可证明是CO2;综上所述,本题答案是:稀盐酸 大理石(或石灰石) 将反应产生的气体通入澄清石灰水中,若变浑浊即可证明是CO2。

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案【题目】“绿水青山就是金山银山”,因此研究NOx、SO2等大气污染物的妥善处理具有重要意义。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的SO2。已知吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3·H2O(aq)==NH4HSO3(aq) △H1=akJ·mol-1;
②NH3·H2O(aq)+NH4HSO3(aq)==(NH4)2SO3(ag)+H2O(l) △H2=bkJ·mol-1;
③2(NH4)2SO3(aq)+O2(g)==2(NH4)2SO4(aq) △H3=ckJ·mol-1。
则反应2SO2(g)+4NH3·H2O(aq)+O2(g)==2(NH4)2SO4(aq)+2H2O(1)的△H=___________kJ·mol-1。
(2)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g)===2CaSO4(s)+2CO2(g)
△H=-681.8kJ·mol-1对煤进行脱硫处理来减少SO2的排放。对于该反应,在T℃时,借助传感器测得反应在不同时间点上各物质的浓度如下:
0 | 10 | 20 | 30 | 40 | 50 | |
O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10min内,平均反应速率v(O2)___________mol·L-1·min-1;当升高温度,该反应的平衡常数K___________(填“增大”“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是___________(填字母)。
A加入一定量的粉状碳酸钙 B通入一定量的O2
C适当缩小容器的体积 D加入合适的催化剂
(3) NOx的排放主要来自于汽车尾气,人利用反应
C(s)+2NO(g)![]() N2(g)+CO2(g) △H=-34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g) △H=-34.0kJ·mol-1,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
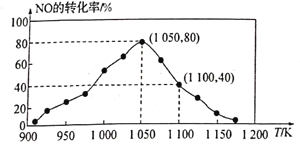
由图可知,1050K前反应中NO的转化率随温度升髙而增大,其原因为____________________;在1100K时,CO2的体积分数为___________。
(4)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=___________[已知:气体分压(P分)=气体总压(Pa)×体积分数]。
(5)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H=-746.8k·mol-1,生成无毒的N2和CO2。实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g) △H=-746.8k·mol-1,生成无毒的N2和CO2。实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数___________(填“>”“<”或“=”)k逆增大的倍数。
②若在1L的密闭容器中充入1 molCO和1 molNO,在一定温度下达到平衡时,CO的转化率为40%,则![]() =___________。
=___________。
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是(提示BaSO4(s)![]() Ba2+(aq)+SO42-(aq)的平衡常数Ksp=c(Ba2+)·c(SO42-),称为溶度积常数。)
Ba2+(aq)+SO42-(aq)的平衡常数Ksp=c(Ba2+)·c(SO42-),称为溶度积常数。)
A.加人Na2SO4可以使溶液由a 点变到b 点
B. 通过蒸发可以使溶液由d 点变到c 点
C.d 点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
【题目】在硫酸工业中,通过下列反应使SO2氧化成SO3:2SO2(g)+O2(g) ![]() 2SO3(g)ΔH=-198kJ·mol-1。下表为不同温度和压强下SO2的转化率(%)
2SO3(g)ΔH=-198kJ·mol-1。下表为不同温度和压强下SO2的转化率(%)
| 1×105 | 5×105 | 1×106 | 5×106 | 1×107 |
450 | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
550 | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
(1)实际生产中,选定400~500℃作为操作温度,其原因是_______________________。
(2)实际生产中,采用的压强为常压,其原因是__________________________________。

