题目内容
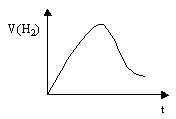
将Zn投入一定浓度一定体积的盐酸中,H2的生成速率与时间的关系如图所示,试解释图中曲线变化的原因(纵坐标为H2的生成速率,横坐标为时间)。
答:① ;
② 。

答:① ;
② 。
①反应开始时,反应放热,反应速率较快;②随着反应的进行,HCl物质的量浓度变小,反应速率又变慢.
本题能力层次为C。Zn与盐酸反应是放热反应,该反应中影响化学反应速率的因素有两个:一是反应放出的热量使反应速率增大;二是反应使HCl物质的量浓度减小,反应速率减小。由图像可知,在开始时温度变化是影响反应速率的主要因素,但随着反应的进行,HCl物质的量浓度的减小是影响反应速率的主要因素。答案:①反应开始时,反应放热,反应速率较快;②随着反应的进行,HCl物质的量浓度变小,反应速率又变慢.
学法指导:本题考查通过图像分析影响化学反应速率的因素。图像分析应注意以下几方面:(1)看起点(2)看终点(3)看变化趋势,分清“渐变”和“突变”,“大变”和“小变”等。
学法指导:本题考查通过图像分析影响化学反应速率的因素。图像分析应注意以下几方面:(1)看起点(2)看终点(3)看变化趋势,分清“渐变”和“突变”,“大变”和“小变”等。

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
 cC(g)+dD(g),1 min后,测得A的浓度为x mol·L-1,这段时间内反应的平均速率若以物质A的浓度变化来表示,应为____________________________________________________________________。
cC(g)+dD(g),1 min后,测得A的浓度为x mol·L-1,这段时间内反应的平均速率若以物质A的浓度变化来表示,应为____________________________________________________________________。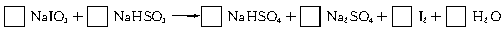
 生成的量,发现开始阶段反应速率呈递增的趋势,试简述这一变化趋势发生的原因: 。
生成的量,发现开始阶段反应速率呈递增的趋势,试简述这一变化趋势发生的原因: 。 Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是( )
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。下列判断正确的是( )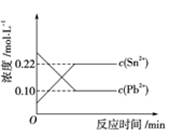
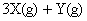

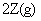 ,若最初加入的X、Y、Z都是2mol,反应中X的平均反应速率为0.12 mol/L·s,若要产物Z为2.6mol,反应需要的时间为___________。
,若最初加入的X、Y、Z都是2mol,反应中X的平均反应速率为0.12 mol/L·s,若要产物Z为2.6mol,反应需要的时间为___________。