题目内容
智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘。
(1)试配平该反应的化学方程式,并用短线标出电子转移方向及总数。
(2)
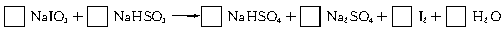
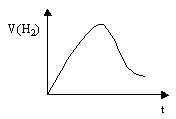
(2)已知含氧酸盐的氧化作用随溶液酸性的加强而增强,在制备实验时,定时取样,并用酸化的氯化钡来检测SO 生成的量,发现开始阶段反应速率呈递增的趋势,试简述这一变化趋势发生的原因: 。
生成的量,发现开始阶段反应速率呈递增的趋势,试简述这一变化趋势发生的原因: 。
(1)试配平该反应的化学方程式,并用短线标出电子转移方向及总数。
(2)
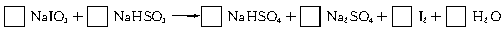
(2)已知含氧酸盐的氧化作用随溶液酸性的加强而增强,在制备实验时,定时取样,并用酸化的氯化钡来检测SO
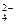 生成的量,发现开始阶段反应速率呈递增的趋势,试简述这一变化趋势发生的原因: 。
生成的量,发现开始阶段反应速率呈递增的趋势,试简述这一变化趋势发生的原因: 。(1)2 5 ="== " 3 2 1 1 (说明:错一个即不给分)
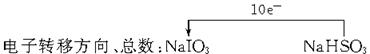
(2)开始阶段由于HSO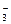 被氧化生成H+和SO
被氧化生成H+和SO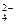 ,酸性加强,反应速度增大
,酸性加强,反应速度增大

(2)开始阶段由于HSO
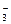 被氧化生成H+和SO
被氧化生成H+和SO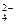 ,酸性加强,反应速度增大
,酸性加强,反应速度增大(1)考查氧化还原方程式的配平;(2)考查影响化学反应速率的外界条件。
由题意,速率加快的原因不可能是:①压强增大;②温度升高;③催化剂的使用;④反应物HSO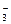 、IO
、IO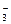 浓度增大。只能是由于5HSO
浓度增大。只能是由于5HSO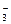 +2IO
+2IO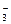 ===5SO
===5SO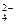 +I2+3H++H2O反应的发生,使得c(H+)浓度增大,酸性增强,反应速率加快(题给信息)。
+I2+3H++H2O反应的发生,使得c(H+)浓度增大,酸性增强,反应速率加快(题给信息)。
由题意,速率加快的原因不可能是:①压强增大;②温度升高;③催化剂的使用;④反应物HSO
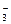 、IO
、IO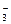 浓度增大。只能是由于5HSO
浓度增大。只能是由于5HSO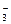 +2IO
+2IO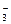 ===5SO
===5SO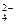 +I2+3H++H2O反应的发生,使得c(H+)浓度增大,酸性增强,反应速率加快(题给信息)。
+I2+3H++H2O反应的发生,使得c(H+)浓度增大,酸性增强,反应速率加快(题给信息)。
练习册系列答案
相关题目
 2SO3(g),在不同条件下测得化学反应速率最快的为( )
2SO3(g),在不同条件下测得化学反应速率最快的为( ) 4C(气)+5D(气)
4C(气)+5D(气)