题目内容
【题目】ClO2是红黄色有毒气体,有刺激性气味,沸点为11℃,极易溶于水但不与水反应,遇热水缓慢水解成次氯酸、氯气和氧气,见光也易分解,因此其溶液置于冷暗处相对稳定。某校合作学习小组的同学欲制备二氧化氯水溶液并检验其性质。
Ⅰ.二氧化氯水溶液制备。
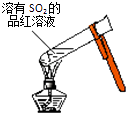
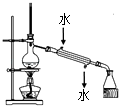
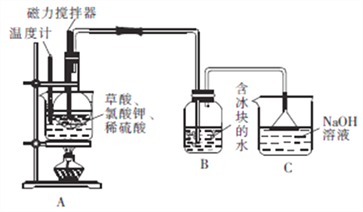
向圆底烧瓶中先加入10gKClO3固体和9gH2C2O4·2H2O(草酸),然后再加入5mL稀硫酸,用磁力搅拌器搅拌(如下图);将烧瓶放在热水浴中,保持水浴温度在60~80℃,至B中广口瓶内溶液呈深红黄色时停止加热。
回答下列问题:
(1)装置A用水浴加热的优点是_________________;装置A中水浴温度不宜低于60℃也不宜高于80℃,其原因是______________________。
(2)装置A中反应生成ClO2及KHSO4等产物的化学方程式为_________________。
(3)装置B的水中需放入冰块的目的是_________________,装置C的作用是_______________
Ⅱ.设计实验验证ClO2的氧化性。
(4)取适量ClO2水溶液加入H2S溶液中,振荡,得无色溶液。欲检验H2S的氧化产物,还需要用到的试剂是_______________________。
(5)证明ClO2的氧化性比Fe3+强的方案是______________________。
(6)将少量ClO2水溶液滴入盛有MnSO4溶液的试管中,振荡,有黑色沉淀生成,则该反应的离子方程式为______________________。
【答案】 受热均匀,且易控制温度 温度低,反应速率慢且生成的ClO2不易逸出;温度过高,会加剧ClO2水解 ![]() (写2KClO3+H2C2O4·2H2O+2H2SO4=2ClO2↑+2CO2↑+2KHSO4+4H2O) 减少ClO2挥发和水解(或其他合理答案) 吸收尾气中的ClO2和Cl2 BaCl2溶液和稀盐酸(或盐酸酸化的BaCl2溶液) 将ClO2气体通入FeSO4溶液中,并滴入KSCN溶液,观察溶液颜色变化,若溶液变为血红色,则证明ClO2的氧化性比Fe3+强(或其他合理答案) 2ClO2+5Mn2++6H2O=5MnO2↓+12H++2Cl-
(写2KClO3+H2C2O4·2H2O+2H2SO4=2ClO2↑+2CO2↑+2KHSO4+4H2O) 减少ClO2挥发和水解(或其他合理答案) 吸收尾气中的ClO2和Cl2 BaCl2溶液和稀盐酸(或盐酸酸化的BaCl2溶液) 将ClO2气体通入FeSO4溶液中,并滴入KSCN溶液,观察溶液颜色变化,若溶液变为血红色,则证明ClO2的氧化性比Fe3+强(或其他合理答案) 2ClO2+5Mn2++6H2O=5MnO2↓+12H++2Cl-
【解析】Ⅰ. (1)装置A用水浴加热的优点是受热均匀,且易控制温度;根据信息可知ClO2极易溶于水但不与水反应,遇热水缓慢水解成次氯酸、氯气和氧气;温度高,加剧ClO2水解,因此装置A中水浴温度不宜过高,但是温度如果太低,反应速率较慢,影响ClO2的生成;因此要控制水浴温度不宜低于60℃也不宜高于80℃;正确答案:受热均匀,且易控制温度;温度低,反应速率慢且生成的ClO2不易逸出;温度过高,会加剧ClO2水解。
(2)KClO3固体和H2C2O4·2H2O固体,在酸性条件下发生氧化还原反应,生成ClO2及KHSO4等,化学方程式为![]() 或(2KClO3+H2C2O4·2H2O+2H2SO4=2ClO2↑+2CO2↑+2KHSO4+4H2O) ;正确答案:
或(2KClO3+H2C2O4·2H2O+2H2SO4=2ClO2↑+2CO2↑+2KHSO4+4H2O) ;正确答案:![]() 或(2KClO3+H2C2O4·2H2O+2H2SO4=2ClO2↑+2CO2↑+2KHSO4+4H2O) 。
或(2KClO3+H2C2O4·2H2O+2H2SO4=2ClO2↑+2CO2↑+2KHSO4+4H2O) 。
(3)装置B的水中需放入冰块,就是给气体ClO2降温,减少ClO2挥发和水解;装置C中氢氧化钠溶液能够吸收尾气中的ClO2和Cl2;正确答案:减少ClO2挥发和水解(或其他合理答案);吸收尾气中的ClO2和Cl2。
Ⅱ.(4)取适量ClO2水溶液加入H2S溶液中,振荡,得无色溶液,说明-2价的硫可能被氧化为亚硫酸根离子或硫酸根离子,因此欲检验H2S的氧化产物,需要用到BaCl2溶液和稀盐酸(或盐酸酸化的BaCl2溶液)进行检验;正确答案:BaCl2溶液和稀盐酸(或盐酸酸化的BaCl2溶液)进行检验。
(5)利用ClO2的氧化性把亚铁离子氧化为铁离子,再利用KSCN溶液检验铁离子的存在;具体操作:将ClO2气体通入FeSO4溶液中,并滴入KSCN溶液,观察溶液颜色变化,若溶液变为血红色,则证明ClO2的氧化性比Fe3+强;正确答案:将ClO2气体通入FeSO4溶液中,并滴入KSCN溶液,观察溶液颜色变化,若溶液变为血红色,则证明ClO2的氧化性比Fe3+强。(或其他合理答案)
(6)ClO2具有氧化性,能够把+2价锰氧化为+4价的黑色沉淀MnO2,反应的离子方程式为:2ClO2+5Mn2++6H2O=5MnO2↓+12H++2Cl-;正确答案:2ClO2+5Mn2++6H2O=5MnO2↓+12H++2Cl-。

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
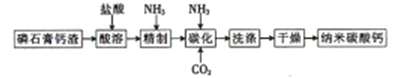
小学同步三练核心密卷系列答案【题目】纳米碳酸钙是一种广泛应用于塑料、食品、医药、饲料等行业的重要无机填料。以磷石膏钙渣为原料制取高品质纳米碳酸钙的工艺流程如下:
已知某磷石膏钙渣的主要成分及其含量如下表所示。
CaO | P2O5 | SO3 | Fe2O3 | Al2O3 | SiO2 | 烧失量 |
47.70% | 1.60% | 1.77% | 0.041% | 0.0027% | 9.85% | 37.69% |
请回答下列问题:
(1)对磷石膏钙渣进行酸溶的目的是获得机制CaCl2溶液,为了提高溶出率,可以采取的措施有______。(回答两条即可)
(2)为了探究酸溶的工艺条件,称取6 份各50g磷石膏钙渣,分别用不同浓度盐酸进行溶解,反应时间为30 min,测得滤液中钙溶出率的结果如图所示,最适宜的盐酸浓度为_______。

(3)精制是向粗制CaCl2溶液中通入氨气,控制溶液的pH,主要除去________ (填金属阳离子)。
(4)碳化时,先将精制CaCl2溶液稀释至一定体积,控制反应温度以及NH3和CO2 的通入量,此过程中,通入气体有先后顺序,应先通入气体的化学式_______(填化学式);碳化时发生反应的化学方程式为______。
(5)把CaCO3浊液滴入1.0molL-1 的Na2SO3溶液中,能否产生CaSO3沉淀?_______。若不能,说明原因;若能,请从定量的角度简述判断依据:_______。[已知:Ksp(CaSO3)=1.4×10-7,Ksp(CaCO3)=2.8×10-9]
(6)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级:__________。
【题目】现使用酸碱中和滴定法测定市售白醋的总酸量(g100ml﹣1).
(1)Ⅰ.实验步骤:
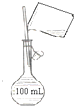
用(填仪器名称)量取10.00mL食用白醋,在烧杯中用水稀释后转移到转移到 (填仪器名称)中定容,摇匀即得待测白醋溶液.
(2)用酸式滴定管取待测白醋溶液20.00mL于锥形瓶中,向其中滴加2滴作指示剂.
(3)读取盛装0.1000mol/L NaOH溶液的碱式滴定管的初始读数.
滴定.当时,停止滴定,并记录NaOH溶液的终读数.重复滴定3次.
(4)Ⅱ.实验记录:
滴定次数 | 1 | 2 | 3 | 4 |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论:
甲同学在处理数据时计算得:平均消耗的NaOH溶液的体积V= ![]() mL=15.24mL.指出他的计算的不合理之处: .
mL=15.24mL.指出他的计算的不合理之处: .
(5)乙同学仔细研究了该品牌白醋的标签,发现其中还含有苯甲酸钠作为食品添加剂,他想用资料法验证醋酸与苯甲酸钠不会发生离子交换反应,需查找在一定温度下醋酸和苯甲酸的(填写序号)
a.电离常数 b.溶解度
(6)在本实验的滴定过程中,下列操作会使实验结果偏大的是(填写序号) .
a.碱式滴定管在滴定时未用标准NaOH溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出.