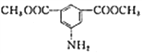
题目内容
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是
A. 25℃,1L pH=13的NaOH溶液中含有OH-的数目为0.1NA
B. 4.6 g NO2和N2O4混合物中含氧原子数为0.3 NA
C. 标准状况下,6.72 L NO2与水反应,转移电子数为0.3 NA
D. 0.1 mol/L NaHCO3溶液中,HCO3-、H2CO3和CO32-总数为0.1NA
【答案】A
【解析】A. 依据n=cV,25℃,1LpH=13的NaOH溶液中OH-的物质的量=1L×0.1mol/L=0.1mol,故A正确;B. 4.6gNO2和N2O4混合物中含有NO2原子团的物质的量为![]() =0.1mol,含有氧原子数为0.2NA,故B错误;C. 标准状况下,6.72LNO2的物质的量为
=0.1mol,含有氧原子数为0.2NA,故B错误;C. 标准状况下,6.72LNO2的物质的量为![]() =0.3mol,与水反应生成硝酸和一氧化氮,转移电子数为0.2NA,故C错误;D. 未告知溶液的体积,无法计算0.1mol/LNaHCO3溶液中,HCO3-、H2CO3和CO32-总数,故D错误;故选A。
=0.3mol,与水反应生成硝酸和一氧化氮,转移电子数为0.2NA,故C错误;D. 未告知溶液的体积,无法计算0.1mol/LNaHCO3溶液中,HCO3-、H2CO3和CO32-总数,故D错误;故选A。

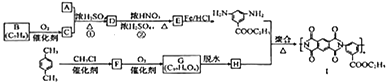
【题目】X、Y、Z 是中学化学中常见的三种物质,下表各组物质之间通过一步反应不能实现右图所示转化关系的是
X | Y | Z | 箭头上所标数字的反应条件 | ||
A. | NO | NO2 | HNO3 | ①常温遇氧气 |
|
B. | Cl2 | NaClO | HClO | ②通入CO2 | |
C. | Na2O2 | NaOH | NaCl | ③加入H2O2 | |
D. | Al2O3 | NaAlO2 | Al(OH)3 | ④加NaOH溶液 |
A. A B. B C. C D. D
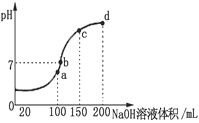
【题目】I.常温下,将某一元酸HA和NaOH溶液等体积混合,分别进行编号为①、②、③的实验,实验数据记录如下表。
序号 | HA物质的量浓度(molL-1) | NaOH物质的量浓度(molL-1) | 混合溶液的pH |
① | 0.1 | 0.1 | pH=9 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH<7 |
(1)根据①组实验情况,分析混合溶液的pH=9的原因是______________________(用离子方程式表示),在该溶液中下列关系式错误的是________________(填标号)。
a.c(Na+)+c(H+)=c(OH-)+c(A-) b.c(Na+)=c(HA)+c(A-)
c.c(HA)+c(H+)=c(OH-) d.c(Na+)+c(H+)=c(OH-)+c(A-)+c(HA)
(2)②组情况表明,c______0.2(填“>”“<”或“=”,下同),混合溶液中:c(A-)_______c(Na+)。
(3)从③组实验结果分析,说明HA的电离程度_____NaA的水解程度(填“>”“<”或“=”),离子浓度由大到小的顺序是_______________________________。
Ⅱ.室温下,若将0.1 molL-1盐酸滴入20mL0.1 molL-1氨水中,溶液pH随加入盐酸体积的变化曲线如下图所示:

(1)NH3·H2O的电离方程式是_______________________________。
(2)b点所示溶液中的溶质是_______________________________。
(3)c点所示溶液中,离子浓度从大到小的关系为_______________________________。